Historia helio, właściwości, struktura, ryzyko, użycia

- 4522
- 713
- Marianna Czarnecki
On hel Jest to element chemiczny, którego symbol jest. Jest to pierwszy szlachetny gaz w stole okresowym i zwykle znajduje się na końcu tego samego. W normalnych warunkach jest to gaz obojętny, ponieważ żaden z jego niewielu związków nie jest stabilny; Rozszerza się również bardzo szybko i jest substancją o najmniejszej temperaturze wrzenia.
Na poziomie popularnym jest to dobrze znany gaz, ponieważ w niezliczonych wydarzeniach lub imprezach dla dzieci jest powszechne. Jednak to, co jest naprawdę i na zawsze utracone w kierunku zakątków układu słonecznego, a poza tym, są to atomy helu, które są uwalniane po rozbiciu globu.
 Balony napompowane helem, najbliżej tego elementu w codziennych sytuacjach. Źródło: Pixabay.
Balony napompowane helem, najbliżej tego elementu w codziennych sytuacjach. Źródło: Pixabay. W rzeczywistości są tacy, którzy i z wielkiego powodu uważają, że balony helu stanowią niewłaściwą praktykę dla tego gazu. Na szczęście ma ważniejsze i interesujące zastosowania, dzięki jego właściwościom fizycznym i chemicznym, które oddzielają go od innych elementów chemicznych.
Na przykład płynny hel jest tak zimny, że może zamrozić wszystko, jak stop metalowy, co czyni go materiałem nadprzewodnikiem. Jest to również płyn, który objawia superflualność, zdolną do wspinania się na ściany szklanego pojemnika.
Nazywał się dlatego, że został po raz pierwszy zidentyfikowany na słońcu, a nie na ziemi. Jest to drugi najliczniejszy element w całym wszechświecie i chociaż jego stężenie jest śmieszne w skórce Ziemi, można go uzyskać z rezerw gazu ziemnego i radioaktywnych minerałów uranu i toru.
Tutaj hel demonstruje kolejny ciekawy fakt: jest to gaz, który obfituje o wiele więcej w podgleście niż w atmosferze, gdzie kończy się uciekając z ziemi i jej pola grawitacyjnego.
[TOC]
Historia
Hel nie został odkryty na ziemi, ale na słońcu. W rzeczywistości jego imię pochodzi od greckiego słowa „helios”, co oznacza słońce. Istnienie samego elementu kontrastowało okresowy tabelę Dmitri Mendeléyev, ponieważ nie było miejsca na nowy gaz; to znaczy, do tego czasu nie było nic o szlachetnych gazach.
Nazwa „Helio”, napisana jako „hel” w języku angielskim, zakończyła się sufiksem -um odnoszącym się do niego jako metalu; Właśnie dlatego, że istnienie innego gazu oprócz tlenu, wodoru, fluoru, chloru i azotu nie mogło zostać przyjęte.
Ta nazwa została wyznaczona przez angielskiego astronomu Normana Lockyera, który studiował z Anglii, co zaobserwował francuski astronom.
Do tego czasu była to żółta linia widmowa nieznanego elementu. Lockyer powiedział, że było to spowodowane obecnością nowego elementu chemicznego znalezionego na słońcu.
W 1895 r., Prawie dwadzieścia lat później, szkocki chemik Sir William Ramsay rozpoznał to samo spektrum z pozostałego gazu podczas badania minerału radioaktywnego: Cleveíta. Dlatego też tu był Helio.
Fizyczne i chemiczne właściwości
Wygląd
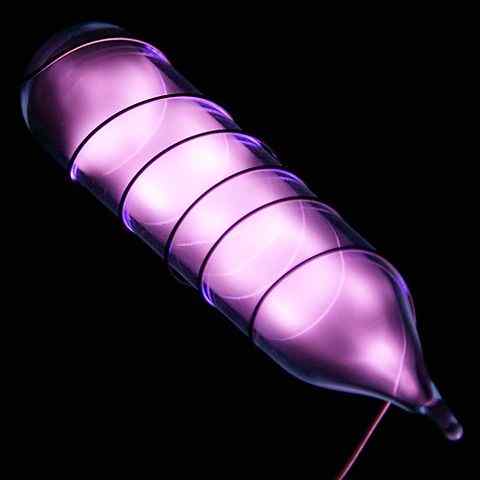 Ampulacja z próbką helu lśniącą po porażeniu elektrycznym. Źródło: Obrazy Hi-Res elementów chemicznych [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]
Ampulacja z próbką helu lśniącą po porażeniu elektrycznym. Źródło: Obrazy Hi-Res elementów chemicznych [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Hel to bezbarwny, bezwonny gaz, który nie ma smaku i jest również obojętna. Jednak po zastosowaniu porażenia prądem i w zależności od różnicy napięcia zaczyna świecić jak mgła szarej (górna część), aby zabłysnąć pomarańczowym blaskiem. Dlatego światła helu są pomarańczowe.
Liczba atomowa (z)
2
Masa cząsteczkowa
4,002 g/mol
Temperatura topnienia
-272,2 ºC
Punkt wrzenia
-268,92 ºC
Gęstość
-0,1786 g/l, w normalnych warunkach, to znaczy w fazie gazowej.
-0,145 g/ml, w temperaturze topnienia, płynny hel.
-0,125 g/ml, właśnie wtedy, gdy hel zaczyna się gotować.
-0,187 g/ml, przy 0 k i 25 atm, to znaczy helu stałego do tych określonych warunków ciśnienia i temperatury.
Potrójny punkt
2177 K i 5 043 kPa (0,04935 atm)
Punkt krytyczny
5 1953 K i 0,22746 MPa (22448 atm)
Fusion Heat
0,0138 kJ/mol
Ciepło parowe
0,0829 kJ/mol
Molowa pojemność cieplna
20,78 J/(mol · k)
Ciśnienie pary
0,9869 ATM przy 4,21 K. Ta wartość służy do przekazania, jak flota.
Energie jonizacyjne
-Po pierwsze: 2372,3 kJ/mol (on+ gazowy)
-Po drugie: 5250,5 kJ/mol (on2+ gazowy)
Energie jonizacyjne dla helu są szczególnie wysokie, ponieważ atom gazowy musi stracić elektron, który doświadcza silnego skutecznego obciążenia jądrowego. Można również zrozumieć, czy rozważany jest niewielki rozmiar atomu i jak „blisko” są dwoma elektronami w odniesieniu do jądra (z ich dwoma protonami i dwoma neutronami).
Rozpuszczalność
W wodzie 0,97 ml rozpuszczane są na 100 ml wody w 0 ° C, co oznacza, że jest ona mało rozpuszczalna.
Może ci służyć: szczawian amonuReaktywność
Hel jest drugim najmniej reaktywnym elementem chemicznym w naturze. W normalnych warunkach skutecznie potwierdzić, że jest to gaz obojętny; Nigdy (za to, co się wydaje) nie można zmanipulować związkiem helu w pokoju lub laboratorium bez działania na nim ogromnych presji; A może dramatycznie wysokie lub niskie temperatury.
Przykład, który widzimy w związku Na2On, który jest stabilny tylko pod ciśnieniem 300 GPa, odtworzona w diamentowej komórce Yunque.
Podczas gdy wiązania chemiczne w Na2Mają „nieznajomych”, że ich elektrony dobrze znajdują się w kryształach, są dalekie od prostych interakcji ścian van der, a zatem nie składają się po prostu z atomów helu uwięzionych przez agregaty molekularne. W tym miejscu dylemat między którym związki helu są rzeczywiste, a które nie.
Na przykład cząsteczki azotu na wysokie ciśnienia mogą uwięzić atom helu, powodując rodzaj stukotu2)jedenaście.
Istnieją również kompleksy podawania endo z kationami fulerenowymi, c60+N i C70+N, w których wgłębie mogą pomieścić atomy helu; i heh kationu molekularnego+ (He-h+), znalezione w bardzo odległych mgławicach.
Numer utleniania
Kto z ciekawości próbuje obliczyć liczbę utleniania helu w dowolnym z jego związków, okaże się, że jest to równe 0. W Na2Można by pomyśleć, że jego formuła odpowiada hipotetycznym jonom NA2+On2-; Ale takie byłoby założenie, że ma on czystą postać jonową, podczas gdy w rzeczywistości jego powiązania są dalekie od bycia.
Ponadto hel nie wygrywa elektronów, ponieważ nie może ich pomieścić na orbicie 2S, niedostępnej energii; I nie jest to ani możliwe, że je stracisz, ze względu na zmniejszoną wielkość atomu i duże skuteczne obciążenie jądrowym jej jądra. Dlatego hel zawsze uczestniczy (teoretycznie) jako atom0 W swoich pochodnych związkach.
Struktura elektroniczna i konfiguracja
Hel, podobnie jak wszystkie gazy obserwowane w makroescala, zajmuje objętość pojemników, które go przechowują, mają w ten sposób nieokreślony sposób. Jednak gdy temperatura schodzi i zaczyna ostygnąć poniżej -269 ºC, gaz skrapja się w bezbarwnej cieczy; Hel I, pierwsza z dwóch faz cieczy dla tego elementu.
Powód, dla którego hel kondensuje się w tak niskiej temperaturze, jest niewiele sił dyspersji, które utrzymują ich atomy razem; Bez względu na fazę. Można to wyjaśnić z konfiguracji elektronicznej:
1s2
W którym dwa elektrony zajmują orbital atomowy 1S. Atom helowy można wizualizować jako prawie idealną kulę, której jednorodne elektroniczne obrzeże nie jest bardzo podatne na polaryzację przez skuteczne obciążenie jądrowe dwóch protonów w jądrze.
Zatem spontaniczne i indukowane momenty dipolowe są rzadkie i bardzo słabe; Tak więc temperatura musi zbliżyć się do bezwzględnego zera, aby atomy zbliżyły się do wystarczającej powolności i sprawiły, że siły dyspersyjne zdefiniowały ciecz; Lub jeszcze lepiej, szklanka helu.
Dimery
W fazie gazowej przestrzeń oddzielająca atomy ma taką, że można założyć, że jeden z pozostałych jest zawsze rozdzielony. Tak bardzo, że w pęcherze, o niewielkiej objętości, hel wygląda bezbarwnie, aż zostanie poddany porażeniu prądem, który jonizuje atomy szarawo i małą jasną mgłą.
Jednak w fazie ciekłej atomy, nawet przy ich słabych interakcjach, nie mogą dłużej „ignorować”. Teraz siła dyspersji pozwala im2. Dlatego możesz myśleć o helu ja jako o ogromnych klastrach2 w równowadze z atomami fazy pary.
Dlatego hel I jest tak trudny do odróżnienia od oparów. Jeśli ten płyn zostanie rozlany na zewnątrz hermetycznego pojemnika, ucieka jak białawe płomienie.
Helio II
Gdy temperatura spada jeszcze bardziej, dotykając 2178 K (-270 972 °.
Od tego momentu fascynujący płyn helowy staje się zbędnym lub kwantowym płynem; Oznacza to, że jego właściwości makroskopowe przejawiają się tak, jakby dimery2 Były to indywidualne atomy (i może są). Brakuje mu całkowitej lepkości, ponieważ nie ma powierzchni, która może zatrzymać atom podczas jego przesuwania lub „wspinaczki”.
Właśnie dlatego Helio II może unosić się przez ściany szklanego pojemnika przezwyciężającego siłę grawitacji; Niezależnie od tego, jak wysokie są, o ile powierzchnia pozostaje w tej samej temperaturze, a zatem nie zmieniają.
Może ci służyć: kwas przysadki (H3PO2): właściwości, zastosowania i odczynnikiZ tego powodu ciekłego helu nie można przechowywać w szklanych pojemnikach, ponieważ uciekłby przed najmniejszą szczeliną lub luką; Bardzo podobny do tego, jak by to stało się z gazem. Zamiast tego do projektowania tych pojemników (zbiorniki DeWars) służy.
Kryształy
Chociaż temperatura spadła do 0 K (bezwzględna zero), siła dyspersji między atomami I nie byłaby wystarczająco silna, aby zamówić je w strukturze krystalicznej. Aby stworzyć zestalenie, ciśnienie musi wzrosnąć do około 25 atm; A potem pojawiają się zwarte kryształy sześciokątne (HCP).
Badania geofizyczne pokazują, że ta struktura HCP pozostaje niezmieniona, że ciśnienie jest zwiększone (do rzędu Pascal Giga, GPA). Istnieje jednak wąski obszar na schemacie temperatury ciśnieniowej, w którym te kryształy HCP cierpią na przejście do fazy sześciennej wyśrodkowanej na ciele (BCC).
Gdzie to jest i uzyskaj
Kosmos i skały
 Hel reprezentuje drugi najliczniejszy element wszechświata i 24% jego masy. Źródło: Pxhere.
Hel reprezentuje drugi najliczniejszy element wszechświata i 24% jego masy. Źródło: Pxhere. Hel jest drugim najliczniejszym elementem w całym wszechświecie, przekraczanym tylko przez wodór. Gwiazdy stale wytwarzają niezmierzone ilości atomów helu poprzez połączenie dwóch rdzeni wodoru podczas procesu nukleosyntezowego.
Podobnie każdy proces radioaktywny, który emituje cząstki α, jest źródłem produkcji atomów helu, jeśli oddziałują one z elektronami środowiska; Na przykład w przypadku ciała skalnego w zbiornikach radioaktywnych minerałów uranu i toru. Te dwa elementy cierpią z rozkładem radioaktywnym, zaczynając od uranu:
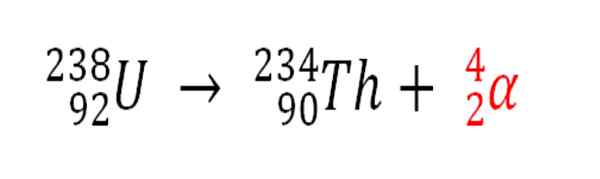 Rozkład radioaktywny u uranu w tworzeniu cząstek Alfas, które następnie przekształcają się w atom helowy w podziemnych osadach. Źródło: Gabriel Bolívar.
Rozkład radioaktywny u uranu w tworzeniu cząstek Alfas, które następnie przekształcają się w atom helowy w podziemnych osadach. Źródło: Gabriel Bolívar. Dlatego w skałach, w których te radioaktywne minerały są skoncentrowane, atomy helu zostaną uwięzione, które zostaną uwolnione po trawieniu w kwaśnych pożywkach.
Wśród niektórych z tych minerałów są Cleveíta, Carnotita i Uraninit, wszystkie składające się z tlenków uranu (UO2 lub u3ALBO8) i zanieczyszczenia toru, metali ciężkich i ziem rzadkich. Hel, nawadniany przez podziemne kanały, może gromadzić się w zbiornikach gazu ziemnego, źródłach mineralnych lub w żelazach meteorycznych.
Szacuje się, że masa helu równoważna 3000 ton jest wytwarzana rocznie, z radioaktywnego rozkładu uranu i toru.
Powietrze i morza
Hel nie jest bardzo rozpuszczalny w wodzie, tak szybciej, a nie później, kończy się z głębokości (gdzie znajduje się jego pochodzenie), aby przekroczyć warstwy atmosfery i wreszcie dotrzeć do przestrzeni znajdującej się. Jego atomy są tak małe i lekkie, że pole grawitacyjne ziemi nie może ich zatrzymać w atmosferze.
Z powodu powyższego stężenie helu zarówno w powietrzu (5,2 ppm), jak i w morzu (4 ppt) jest bardzo niskie.
Gdybyś chciał wyodrębnić z dowolnego z tych dwóch mediów, opcją „najlepszą” byłoby powietrze, które najpierw musiałoby przedłożyć je upłynnieniem, aby skondensować wszystkie swoje składniki, podczas gdy hel pozostaje w stanie gazowym.
Jednak uzyskanie helu z powietrza nie jest praktyczne, ale ze skał wzbogaconych w radioaktywne minerały; lub jeszcze lepiej, rezerw gazu ziemnego, w których hel może reprezentować do 7% całkowitej masy.
Upłynnienie i destylacja gazu ziemnego
Zamiast podlegać powietrzu, jest to łatwiejsze i bardziej opłacalne. Zatem surowca par doskonałości (komercyjna) w celu uzyskania helu jest gaz ziemny, który można również przedłożyć do destylacji ułamkowej.
Końcowy produkt destylacji jest gotowy oczyszczanie węglem aktywnym, który przechodzi przez wielki hel czystości. I wreszcie, hel oddziela się od neonu poprzez kriogeniczny proces, w którym stosuje się płynny hel.
Izotopy
Hel jest prezentowany głównie jako izotop 4On, którego nagie jądro jest słynną cząsteczką α. Ten atom 4Mam dwa neutrony i dwa protony. W mniejszej liczebności jest izotop 3Ten, który ma tylko jeden neutron. Pierwszy jest cięższy (ma większą masę atomową) niż druga.
Zatem para izotopów 3On i 4Mają te, które definiują nadmierne właściwości i to, co rozumiemy hel jako element chemiczny. Od 3Jest lżejszy, zakłada się, że ich atomy mają więcej energii kinetycznej i dlatego potrzebują jeszcze niższej temperatury, aby spójne w zbędnym.
On 3Rozważałem bardzo rzadki gatunek tutaj na Ziemi; Jednak w glebach księżycowych jest bardziej obfite (około 2000 razy). Właśnie dlatego Księżyc był przedmiotem projektów i historii jako możliwego źródła 3On, który mógłby być wykorzystany jako paliwo jądrowe na statek kosmiczny przyszłości.
Może ci służyć: czyste substancjeWśród innych izotopów helowych można wymienić, z ich odpowiednimi czasami pół -life: 5ON (T1/2= 7,6 · 10−22 S), 6ON (T1/2= 0,8 s) i 8ON (T1/2= 0,119 s).
Ryzyko
Hel jest gazem obojętnym, a zatem nie uczestniczy w żadnej z reakcji występujących w naszym ciele.
Jego atomy praktycznie wchodzą i są wydychane bez ich interakcji z biomolekułami wytwarzającymi późniejszy efekt; Z wyjątkiem dźwięku emitowanego z przewodów głosowych, które stają się bardziej ostre i mają większą częstotliwość.
Ludzie, którzy wdychają Helio z balonu (z umiarem), mówią ostrym głosem, podobnym do wiewiórki (lub kaczki).
Problem polega na tym, że jeśli wspomniana osoba wdycha niewłaściwą ilość helu, ryzyko duszących biegów, ponieważ ich atomy przechodzą do cząsteczek tlenu; I dlatego nie będzie w stanie oddychać, dopóki cały ten hel nie wydychnie, co z kolei z powodu jego ciśnienia nie może rozerwać tkanki płucnej lub spowodować barotraumę.
Przypadki osób, które zmarły z powodu wdychania Helio, zostały zgłoszone z powodu nowo wyjaśnionych.
Z drugiej strony, chociaż nie reprezentuje ryzyka pożaru, biorąc pod uwagę jego brak reaktywności na tlen (lub inną substancję), jeśli jest przechowywany pod wysokim ciśnieniem i ucieczką, jego ucieczka może być fizycznie niebezpieczna.
Aplikacje
Właściwości fizyczne i chemiczne Helio nie tylko czynią go specjalnym gazem, ale także bardzo przydatną substancją dla zastosowań, które zasługują na temperatury w bardzo niskim poziomie. W tej sekcji niektóre z tych aplikacji lub zastosowania zostaną rozwiązane.
Systemy ciśnienia i czyszczenia
W niektórych systemach konieczne jest zwiększenie ciśnienia (pod presją), a w tym celu musi być wstrzykiwana lub zasilana, która nie oddziałuje z żadnym z jego składników; Na przykład z odczynnikami lub powierzchniami wrażliwymi na niepożądane reakcje.
Zatem ciśnienie można zwiększyć w przypadku objętości helu, których bezwładność chemiczna czyni ją idealną do tego celu. Obywatna atmosfera, która ułatwia przekracza w niektórych przypadkach azotu.
W przypadku procesu odwrotnego, to znaczy, że hel jest również używany ze względu na jego zdolność do przeciągania całego tlenu, oparów wodnych lub innego gazu, którego obecność chce wyeliminować. W ten sposób ciśnienie układu jest zmniejszone po opróżnieniu helu.
Wykrywanie wycieków
Hel można przefiltrować przez najmniejszą szczelinę, więc służy również do wykrywania wycieków w rurach, pojemnikach o wysokiej prakcie lub zbiornikach kriogenicznych.
Czasami wykrywanie można wykonywać wizualnie lub dotykiem; Jednak głównie detektor jest tym, co „rzuca” sygnał tego, gdzie i ile helu ucieka przed systemem pod kontrolą.
Drag Gas
Atomy helu, jak wspomniano dla systemów oczyszczania, mogą go przeciągnąć, w zależności od ciśnienia, cięższych cząsteczek. Na przykład ta zasada jest stosowana codziennie w analizie chromatografii gazowej, ponieważ może ona przeciągnąć próbkę rozpyloną wzdłuż kolumny, gdzie oddziałuje z fazą stacjonarną.
Balony i sterowce
 Hel służy do napompowania sterowców i jest znacznie bezpieczniejszy niż wodór, ponieważ nie jest to łatwopalny gaz. Źródło: Pixabay.
Hel służy do napompowania sterowców i jest znacznie bezpieczniejszy niż wodór, ponieważ nie jest to łatwopalny gaz. Źródło: Pixabay. Ze względu na niską gęstość w porównaniu do powietrza i ponownie z brakiem reaktywności z tlenem, został użyty do nadmuchania balonów na imprezach dziecięcych (zmieszanych z tlenem, aby nikt nie był dusiony do oddychania) i sterowców (obraz doskonały) , bez możliwości reprezentowania ryzyka pożaru.
Nurkować
 Hel jest jednym z głównych składników zbiorników tlenu, z którymi nurkowie oddychają. Źródło: Pxhere.
Hel jest jednym z głównych składników zbiorników tlenu, z którymi nurkowie oddychają. Źródło: Pxhere. Kiedy nurkowie schodzą na większe głębiny, trudno im oddychać w wyniku wielkiego ciśnienia wywieranego przez wodę. Właśnie dlatego Helio jest dodawany do swoich zbiorników tlenu, aby zmniejszyć gęstość gazu, którą nurkowie oddychają i wydechowe, a zatem można go wydychać z mniejszą pracą.
Spawanie łukowe
W procesie spawania łuk elektryczny przynosi wystarczającą ilość ciepła, dzięki czemu dwa metale zostały połączone. Jeśli zostanie wykonywany w atmosferze helu, żarowy metal nie zareaguje z tlenem powietrza, aby stać się jego odpowiednim tlenek; Dlatego hel zapobiega temu.
Nadprzewodnicy
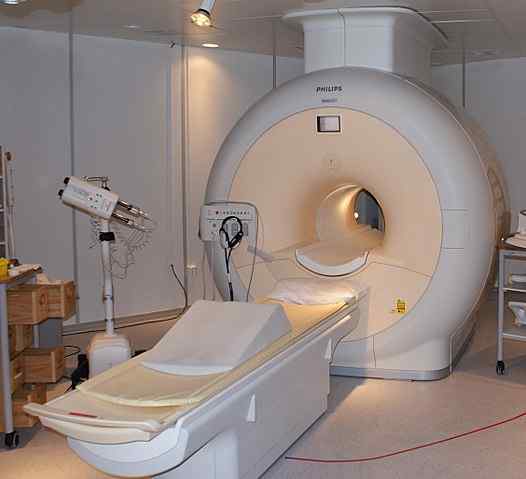 Ciekawy hel służy do przechowywania magnesów stosowanych w skanerach jądrowego rezonansu magnetycznego. Źródło: Jan Ainali [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]
Ciekawy hel służy do przechowywania magnesów stosowanych w skanerach jądrowego rezonansu magnetycznego. Źródło: Jan Ainali [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Płynny hel jest tak zimny, że może zamrozić metale, aby przekształcić je w nadprzewodniki. Dzięki temu wyprodukowano bardzo mocne magnesy, które w lodówce z ciekłym helem zostały użyte w obrazach obrazów lub spektrometrów jądrowego rezonansu magnetycznego.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Andy Estance. (17 kwietnia 2019). Jon wodordu helu wykryty w przestrzeni po raz pierwszy: dowody znalezione na nieuchwytną chemię z pierwszych minut wszechświata. Odzyskane z: ChemistryWorld.com
- Peter Wothers. (19 sierpnia 2009). Hel. Chemia w swoim żywiole. Odzyskane z: ChemistryWorld.com
- Wikipedia. (2019). Hel. Źródło: w:.Wikipedia.org
- Mao, h. K., Wu i., Jephcoat, a. P., Hemley, r. J., Bell, str. M., & Bassett, w. DO. (1988). Struktura krystaliczna i gęstość helu do 232 kbar. Źródło: artykuły.Adsab.Harvard.Edu
- National Center for Biotechnology Information. (2019). Hel. Baza danych Pubchem. CID = 23987. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Mary-Ann Muffoletto. (6 lutego 2017). W górę, w górę i odejście: chemicy mówią „tak”, hel może tworzyć związki. Utah State University. Odzyskane z: Phys.org
- Steve Gagnon. (S.F.). Izotopy helu elementu. Jefferson Lab. Odzyskane z: edukacja.Jlab.org
- Advameg, inc. (2019). Hel. Odzyskane z: chemistryrexplaed.com

