Funkcje, struktura, funkcje, funkcje
- 1732
- 254
- Herbert Wróblewski
Glut2 Jest to transporter glukozy o niskim powinowactwie, który jest wyrażany w błonach trzustki, wątroby, nerki i komórek jelitowych, a także w astrocytach i tanitos. Oprócz pośredniczenia w transporcie glukozy, bierze również udział w transporcie fruktozy, galaktozy i glukozaminy; Więc więcej niż przenośnik glukozy to heksowy transporter.
Fakt przedstawienia niskiego powinowactwa do glukozy pozwala działać jako białko czujnika o poziomie glukozy we krwi. Dlatego uczestnictwo w kontroli regulacyjnej wielu zdarzeń fizjologicznych, które reagują na fluktuacje stężenia glukozy we krwi.
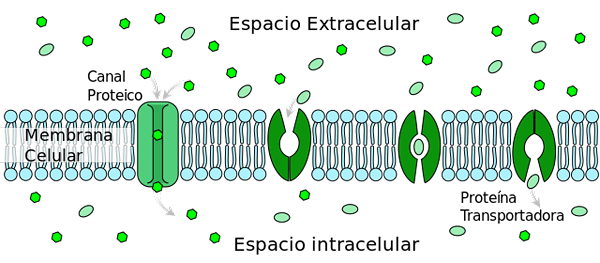
 Ułatwiony transport dyfuzyjny glukozy typu 2 (GLUT2) zmienia konformację mobilizując miejsce wiązania glukozy od strony zewnętrznej do wewnętrznej strony błony (białko przenośne). Autor: Ladyofhats [domena publiczna] (https: // creativeCommons.Org/licencje/by-sa/3.0)], z Wikimedia Commons.
Ułatwiony transport dyfuzyjny glukozy typu 2 (GLUT2) zmienia konformację mobilizując miejsce wiązania glukozy od strony zewnętrznej do wewnętrznej strony błony (białko przenośne). Autor: Ladyofhats [domena publiczna] (https: // creativeCommons.Org/licencje/by-sa/3.0)], z Wikimedia Commons. Wśród licznych procesów regulujących są: 1) uwalnianie insuliny przez komórki trzustki stymulowane przez wysokie stężenie glukozy; 2) Wydzielanie glukagonu przez hepatocyty do produkcji glukozy w przypadkach hipoglikemii.
[TOC]
Transport glukozy do wnętrza komórki
Około 75% glukozy, która dostaje się do komórki w celu zasilania szlaków metabolicznych produkcji energii, wykonuje to poprzez pasywny mechanizm transportu ułatwiony przez kompleksowe białka błonowe zwane transporterami.
Ten mechanizm transportu jest powszechnie znany jako dostarczany rozpowszechnianie. Nie wymaga przeprowadzenia wkładu energii i jest podawany na korzyść gradientu stężenia. To znaczy ze strefy wysokiego stężenia do niskiego stężenia.
Do tej pory zidentyfikowano co najmniej 14 izoform transperatorów dyfuzyjnych ułatwionych glukozy, w tym GLUT2. Wszystkie należące do głównych facylitatorów nadrodziny (MSF) i, przez konsensus, zwane gluts (przez akronim w języku angielskim „transporterów glukozy”).
Może ci służyć: myitosis: fazy, cechy, funkcje i organizmyRóżne glut, które zostały do tej pory scharakteryzowane, są kodowane przez geny SLC2A i wykazują wyraźne różnice w sekwencji aminokwasowej, preferencje dla substratów, które transportują oraz w komórek i rozkładu tkanek.
Charakterystyka GLUT2
GLUT2 mobilizuje glukozę poprzez mechanizm transportu pojedynczego kierunku (uniporta). Ta funkcja jest również wykonywana GLUT1, najliczniejszy przenośnik glukozy u praktycznie wszystkich ssaków.
Jednak w przeciwieństwie do tego ma wyjątkowo niskie powinowactwo z powodu glukozy, co oznacza, że jest on w stanie przetransportować tylko wtedy, gdy stężenia tego cukru zwykle osiągają bardzo wysokie wartości w pożywce pozakomórkowej.
Pomimo niskiego powinowactwa do glukozy, przedstawia wysoką pojemność transportową, co oznacza, że może przetransportować duże ilości tej heksozy z dużą prędkością. Te dwie cechy wydają się związane z rolą, jaką ten transporter musi reagować na subtelne zmiany stężenia glukozy.
Badania charakterystyki molekularnej tego transportera wykazały, że nie stanowi to jednej specyficzności z powodu glukozy. Przeciwnie, jest w stanie pośredniczyć w pasywnym transporcie fruktozy, galaktozy, dłoni i glikozaminy. Prezentując niskie powinowactwo do pierwszych trzech i wysokiego powinowactwa do glukozaminy.
Ponieważ wszystkie te cząsteczki są cukrami sześciu atomów węgla, można je uznać za transporter heksowy niż transporter glukozy.
Struktura GLUT2
Glut2 przedstawia 55% sekwencję peptydową identyczną z sekwencją transportera o wysokim powinowactwie do glukozy GLUT1.
Jednak pomimo tego niskiego odsetka podobieństwa między sekwencjami obu transporterów, badania przeprowadzone przez krystalografię X -Bray wykazały, że mają one podobną strukturę.
Może ci służyć: cytoszkieletTa struktura odpowiada strukturze wielofembraalnego białka w helisie α. Oznacza to, że wielokrotnie przecina membranę przez segmenty transbłonowe, które mają konfigurację α-helisy.
Podobnie jak we wszystkich członkach super rodziny głównych facylitatorów (MSF), do których należy, 12 segmentów spiralnych przekracza błonę. Sześć z nich jest przestrzennie przestawiona, tworząc porę hydrofilową, przez którą mobilizowane są cukry.
Należy zauważyć, że miejsce Unii Heksozy jest zdefiniowane przez orientację i pseudopsymetrię przedstawione przez końcowe końcowe końcówki karboksylowe i aminowe białka. Oba wystawione na tę samą stronę błony wytwarzają wnękę, w której rozpoznawanie sześciu atomów cukru ułatwiające ich związek.
Zmiana struktury przenośnika jest związana z mechanizmem stosowanym przez to do transportu cukrów z jednej strony membrany. Ta strukturalna deformacja umożliwia mobilizację miejsca Unii do strony cytoplazmatycznej, gdzie szybko następuje uwalnianie cząsteczki, która została przetransportowana.
Funkcje GLUT2
Oprócz pośredniczącego glukozy, galaktozy i glukozaminy porywających wewnątrz komórki, liczne funkcje fizjologiczne przypisano ekspresji tego transportera w różnych typach komórkowych.
Wiele z tych funkcji zostało określonych przy użyciu technik supresji genów. Ten ostatni składa się z zapobiegania ekspresji genu, którego funkcja jest pożądana do badania w komórkach określonej tkanki lub pełnego organizmu.
W tym sensie blokada ekspresji GLUT2 u myszy ujawniła, że to białko stanowi główny sposób transportu glukozy zarówno w komórkach nerkowych, jak i wątroby. Oprócz transportu galaktozy i fruktozy nie jest związane z wytwarzaniem glukozy z tych cukrów poprzez glukoneogenezę.
Może ci służyć: stromatolityDodatkowo wykazano, że wywiera regulacyjną rolę różnych funkcji fizjologicznych, ponieważ jego niskie powinowactwo glukozy pozwala mu wykryć, gdy stężenia tego cukru są wysokie.
Papier GLUT2 w utrzymaniu homeostazy komórkowej
Ponieważ spełnia krytyczną funkcję w wytwarzaniu energii przez wszystkie komórki szczególnie dla komórek nerwowych, jego stężenie krwi musi być utrzymywane w pobliżu wartości 5 mmol/l. Różnice w tym stężeniu są zawsze monitorowane przez białka regulacyjne poprzez mechanizmy „wykrywania glukozy”.
Te mechanizmy składają się ze strategii molekularnych, które pozwalają szybko reagować na nagłe zmiany stężenia glukozy. W tym sensie ekspresja GLUT2 w błonie komórkowej, której funkcje są aktywowane przez hiperglikemię, nadaje rolę regulacyjną.
W rzeczywistości wykazano, że wydzielanie insuliny przez komórki trzustki jest wywoływane przez wykrywanie glukozy przez GLUT2.
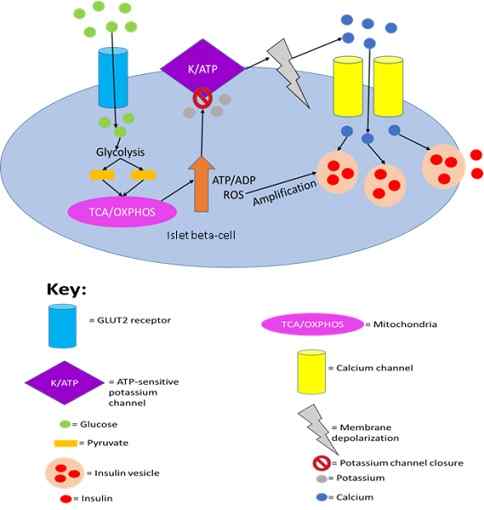
Wydzielanie insuliny przez komórki trzustki jest wystrzeliwane przez wykrywanie glukozy przez GLUT2. Joshua J Reed [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons.
Dodatkowo przeciętnie autonomiczna kontrola nerwowa żywności, termoregulacja i obsługa komórek trzustki stymulowanych przez wykrywanie glukozy.
Gdy poziomy GLUT2 zmniejszają się w komórkach nerwowych, generują dodatni sygnał do wyzwalania wydzielania glukagonu. Pamiętając, że glukagon jest hormonem, który promuje wytwarzanie glukozy przez wątrobę z rezerw glikogenowych.
Bibliografia
- Burcelin R, Thorens B. Dowody, że ekstrapancreatowe zależne od glutowania czujniki glukozy ControllCon Secret. Cukrzyca. 2001; 50 (6): 1282-1289.
- Kellett GL, Brot-Loche E, Mace OJ, Letturque A. Absorpcja cukru w jelicie: rola GLUT2. Annu Rev Nutr. 2008; 28: 35-54.
- Lamy CM, Sanno H, Labouèbe G, Picard A, Magnan C, Chatton JY, Thorens B. Aktywowane hipoglikemią neurony GLUT2 w jądrze Tractus Solutities Strumulalatines Aktywność pochwa i tajemnica glukagonu. Metab komórki. 2014; 19 (3): 527-538.
- Mueckler M, Thorens B. Rodzina transporterów membranowych SLC2 (GLUT). Mol Aspects Med. 2013; 34 (2-3): 121-38.
- Tarussio D, Metref S, Seyer P, Mounien L, Vallelis D, Magnan C, Foretz M, Thorens B. Nerwowe wykrywanie glukozy reguluje poporodową proliferację komórek β i homeostazę glukozy. J Clin Invest. 2014; 124 (1): 413-424.
- B. GLUT2 w trzustce i expanreatic glucuco-detekcji (recenzja). Mol Memb Biol. 2001; 18 (4): 265-273.
- Thorens B, Mueckler M. Transportery glukozy w XXI wieku. Am J Physiol Endocrinol Metab. 2010; 298 (2): E141-E145.
- Thorens b. Glut2, wykrywanie glukozy i homeostaza glukozy. Diabetologia. 2015; 58 (2): 221-232.
- « Cechy albaricoque, siedlisko, właściwości, uprawa
- Charakterystyka kojotu, siedlisko, jedzenie, reprodukcja »

