Funkcje glikolizy, enzymy, fazy, produkty, znaczenie
- 914
- 252
- Prokul Woliński
Glikoliza o glikoliza jest główną drogą katabolizmu glukozy, której ostatecznym celem jest uzyskanie energii w postaci mocy zmniejszającej ATP i NADH, z tego węglowodanów.
Ta trasa, całkowicie wyjaśniona w latach 30. XX wieku przez Gustav Embden i Otto Meyerhof podczas badania zużycia glukozy w komórkach mięśni szkieletowych, składa się z całkowitego utleniania wspomnianego monosacharydu i sama w sobie reprezentuje szlak beztlenowy dla uzyskania energii.
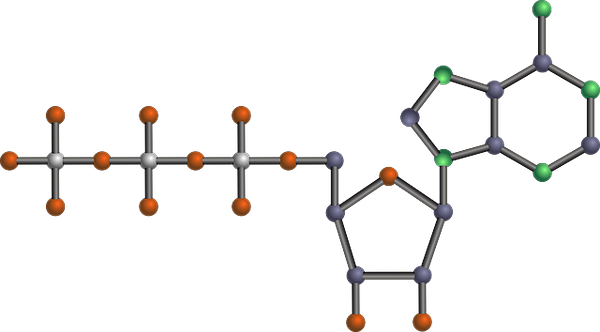
 Struktura molekularna ATP, jeden z produktów glikolitycznych (podsumowanie szlaku glikolitycznego (Źródło: Tekks w English Wikipedia/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons) Via Wikimedia Commons)
Struktura molekularna ATP, jeden z produktów glikolitycznych (podsumowanie szlaku glikolitycznego (Źródło: Tekks w English Wikipedia/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons) Via Wikimedia Commons) Jest to jedna z głównych dróg metabolicznych, ponieważ występuje, z jego różnicami, we wszystkich istniejących organizmach żywych, jednokomórkowych lub wielokomórkowych, prokariotów lub eukarionotów, i uważa się, że jest to łańcuch reakcji bardzo zachowanych ewolucyjnie o naturze natury natury natury natury z natury natury natury natury natury natury natury natury natury natury natury natury natury natury natury natury natury natury natury charakter ewolucyjnie.
W rzeczywistości istnieją niektóre organizmy i typy komórek, które zależą wyłącznie od tej drogi do utrzymania.
Po pierwsze, glikoliza składa się z utleniania glukozy, 6 atomów węgla, do pirogronianu, który ma trzy atomy węgla; Z towarzyszącą produkcją ATP i NADH, przydatną dla komórek z metabolicznego i syntetycznego punktu widzenia.
W tych komórkach zdolnych do dalszego przetwarzania produktów uzyskanych z katabolizmu glukozy, glikoliza kończy się na wytwarzaniu dwutlenku węgla i wody przez cykl Krebsa i łańcuch przenośnika elektronów (aerobowa glikoliza).
Dziesięć reakcji enzymatycznych zachodzi w trakcie trasy glikolitycznej i chociaż regulacja tych reakcji może być czymś innym niż jeden gatunek na inny, mechanizmy regulacji są również dość zachowane.
[TOC]
Funkcje glikolizy
Z metabolicznego punktu widzenia glukoza jest jednym z najważniejszych węglowodanów dla wszystkich żywych istot.
Jest to stabilna i bardzo rozpuszczalna cząsteczka, dzięki czemu może być transportowana ze względną łatwością w całym ciele zwierzęcia lub rośliny, skąd jest przechowywana i/lub uzyskana do miejsca, w którym jest potrzebne jako paliwo komórkowe.
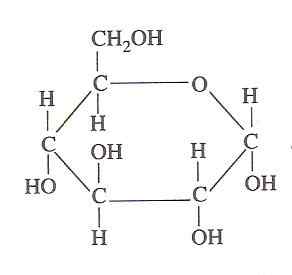 Struktura glukozy (Źródło: Oliva93/cc by-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons)
Struktura glukozy (Źródło: Oliva93/cc by-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons) Energia chemiczna zawarta w glukozie jest wykorzystywana przez żywe komórki poprzez glikolizę, która składa się z serii niezwykle kontrolowanych etapów, w których energia uwolniona z utleniania tego węglowodanów w bardziej użytecznych formach energii może być „przechwycona”, stąd jej znaczenie.
Dzięki tej trasie uzyskuje się nie tylko energię (ATP) i moc redukującej (NADH), ale zapewnia serię metabolicznych pośredników, które są częścią innych dróg, również ważne z anabolicznego (biosyntetycznego) i ogólnego działania komórkowego. Oto lista:
- 6-fosforan glukozy dla trasy fosforanu pentosas (PPP, angielski Pantos Mushco Pathway)
- Pirogronian fermentacji mlekowej
- Pirogronian dla syntezy aminokwasów (głównie alanina)
- Pirogronian cyklu kwasu trikarboksylowego
- Fruktoza 6-fosforan, fosforan glukozy i fosforan dihydroksyacetoniczny, które działają jako „bloki konstrukcyjne” na innych drogach, takich jak synteza glikogenu, kwasy tłuszczowe, trójglicerydy, nukleotydy, aminokwasy itp.
Produkcja energii
Ilość ATP wytwarzana przez ścieżkę glikolityczną.
Jednak jeśli chodzi o komórki tlenowe, glikoliza działa również jako źródło energii awaryjnej i służy jako „krok przygotowawczy” przed oksydacyjnymi reakcjami fosforylacji, które charakteryzują komórki z metabolizmem tlenowym.
Enzymy uczestniczące w glikolizy
Glikoliza jest możliwa tylko dzięki uczestnictwu 10 enzymów, które katalizują reakcje charakteryzujące tę trasę. Wiele z tych enzymów jest formą alosteryczną i zmieniającą lub konformację, gdy wykonują swoje funkcje katalityczne.
Istnieją enzymy, które rozbijają i tworzą kowalencyjne wiązania między ich podłożami, a są inne, które wymagają określonych kofaktorów do wykonywania swoich funkcji, głównie jonów metalicznych.
Strukturalnie wszystkie enzymy glikolityczne mają centrum zasadniczo uformowane przez arkusze β równolegle otoczony przez Hellice α i zamówiono w więcej niż jednej domenie. Ponadto enzymy te są scharakteryzowane, ponieważ ich aktywne strony są zwykle w miejscach związkowych między domenami.
Należy również podkreślić, że główna regulacja trasy przechodzi przez kontrolę (hormonalne lub metabolity) enzymów, takich jak heksochinaza, fosfofrucerachinaza, dehydrogenaza 3-fosforanowa gliceraldehydu i kinaza pirogronianowa i kinaza piruwianowa.
Może ci służyć: miąższ płucny: opis, histologia, choroby Główne punkty regulacji ścieżki glikolitycznej.Org/licencje/by-sa/3.0) Via Wikimedia Commons)
Główne punkty regulacji ścieżki glikolitycznej.Org/licencje/by-sa/3.0) Via Wikimedia Commons) 1- heksochinaza (HK)
Pierwsza reakcja glikolizy (fosforylacja glukozy) jest katalizowana przez heksochinazę (HK), której mechanizm działania wydaje się polegać na „indukowanej regulacji” przez substrat, który promuje „zamknięcie” enzymu wokół ATP i glukozy (glukozę ( jego podłoża) po dołączeniu do nich.
W zależności od rozważanego organizmu może istnieć jeden lub więcej izoenzymów, których masa cząsteczkowa waha się między 50 (około 500 aminokwasów) do 100 kDa, ponieważ wydaje się, że są one pogrupowane w postaci granic, których formowanie jest faworyzowane przez The the the the The Obecność glukozy, jonów magnezu i ATP.
Heksochinaza ma otwartą strukturę trzeciorzędową złożoną z arkuszy alfa i beta, chociaż istnieje wiele różnic strukturalnych w tych enzymach.
2- Izomeraza fosfoglukozy (PGI)
Fosforylowana glukoza przez heksochinazę jest izomeryzowana do 6-fosforanu fruktozy za pomocą izomerazy fosfoglukozy (PGI), znanej również jako izomeraza 6-fosforanowa glukozy 6-fosforan. Enzym nie usuwa ani nie dodaje atomów, ale raczej zmienia je na poziomie strukturalnym.
Jest to aktywny enzym w postaci dymorycznej (monomer waży mniej więcej 66 kDa) i bierze udział nie tylko w glikolizy, ale także w glukoneogenezę w syntezie węglowodanów w roślinach itp.
3- fosfofrutekwinaza (PFK)
6-fosforanowa fruktoza to substrat dla enzymu fosfofrucerachinazy, który jest w stanie ponownie fosforylacja ta cząsteczka ATP jako dawcy grupy fosforyl.
Enzym ten istnieje u bakterii i ssaków jako enzym homotrameryczny (złożony z czterech identycznych podjednostek 33 kDa dla bakterii i 85 kDa na ssakach), a u drożdży jest to oktametr (składający się z większych podjednostek, między 112 i 118 kDa).
Jest to enzym alosteryczny, co oznacza, że jest on pozytywnie lub negatywnie regulowany przez którykolwiek z jego produktów (ADP) i inne cząsteczki, takie jak ATP i cytrynian.
4- Aldolaza
Znana również jako aldolaza fruktozy 1,6-bifosforan, aldolaza katalizuje katalizat katalityczny fruktozy 1,6-bifosforanu w dihydroksyacetonu fosforanu i reakcja glicerki 3-fosforanu i reakcja reakcji, czyli zjednoczeniem cukru.
Innymi słowy, enzym ten przecina fruktozę 1,6-bifosforan tuż w środku, uwalniając dwa fosforylowane związki 3 atomów węgla. Aldolaza składa się również z 4 identycznych podjednostek, każda z własnym miejscem aktywnym.
Wyznaczono istnienie dwóch klas (I i II) tego enzymu, które różnią się mechanizmem reakcji, która katalizuje i ponieważ niektóre (pierwsze) występują w „niższych” bakteriach i eukariotach, a inne (pozostałe (inne (inne (inne (inne (inne ( drugi) znajdują się w bakteriach, protogach i metazoos.
Aldolaza „doskonałych” eukariotów składa się z homotermetru podjednostek o masie cząsteczkowej 40 kDa, każda utworzona przez luf złożoną z 8 arkuszy β/α.
5- izomeraza triosa-fosforanowa (TIM)
Dwa fosforylowane triosas można ze sobą połączyć dzięki działaniu izomerazy triosa-fosforanu, co pozwala na stosowanie obu cukrów podczas glikolizy, zapewniając całkowite zastosowanie każdej cząsteczki glukozy, która wchodzi do drogi.
Ten enzym został opisany jako „idealny” enzym, ponieważ katalizuje reakcję opisaną około miliarda razy szybciej niż byłoby to bez udziału. Jego aktywne miejsce znajduje się w centrum struktury beta-baruli, charakterystycznej dla wielu enzymów glikolitycznych.
Jest to białko dimérica, utworzone przez dwa identyczne podjednostki około 27 kDa, oba o strukturze kulistej.
6- dehydrogenaza 3-fosforanu gliceraldehydowego (GAPDH)
3-fosforan gliceraldehydu wytwarzany przez działanie izomerazy triosa-fosforanu służy jako substrat dla GAPDH, który jest enzymem homoteramerycznym (34-38 kDa każdej podjednostki), który kooperacyjnie wiąże się z cząsteczką NAD++ , a także 2 jony fosforanowe lub siarczanowe.
W tym przejściu trasy enzym umożliwia fosforylację jednego z jego substratów zastosowanych fosforanu nieorganicznego jako dawcy grupy fosforylowej, z jednoczesnym zmniejszeniem dwóch cząsteczek NAD+ i produkcją 1,3-bifosppphoglicerato.
7- kinaza Fosfoglicerato (PGK)
Kinaza fosfoglicenitowa jest odpowiedzialna za przeniesienie jednej z grup fosforanowych 1,3-bifosfoglikanu do cząsteczki ADP z powodu fosforylacji na poziomie substratu. Ten enzym wykorzystuje mechanizm podobny do stosowanego przez heksochinazę, ponieważ zamyka się, aby kontaktować się na podłożach, chroniąc je przed cząsteczkami wody.
Może ci służyć: aponeuroza: cechy, funkcje, lokalizacjaTen enzym, podobnie jak inne, które używają dwóch lub więcej substratów, mają miejsce wiązania dla ADP, a drugi dla cukru fosforanowego.
W przeciwieństwie do innych opisanych enzymów, białko to jest monomerem 44 kDa o strukturze bilobularnej, złożonej z dwóch domen tego samego rozmiaru połączonego wąskim „rowkiem”.
8- Mutaza fosfoglicenianu
3-fosfogliceryniana ulega zmianie z grupy fosforanowej na węgiel 2, na środku cząsteczki, która reprezentuje strategiczne miejsce niestabilności, które ułatwia późniejsze przeniesienie grupy na cząsteczkę ATP w ostatniej reakcji trasy trasy.
To tylneglo jest katalizowane przez enzym fosfogliceryną Mutasę, enzym dimérica dla ludzi i tetrameryczny dla drożdży, o wielkości podjednostki blisko 27 kDa.
9- enolaza
Enolaza katalizuje odwodnienie 2-fosfogliceryny do fosfoenolpirogronianu, niezbędny etap do wytwarzania ATP w następującej reakcji.
Jest to enzym dimérica złożony z dwóch identycznych podjednostek 45 kDa. Zależy to od jonów magnezu w zakresie stabilności i zmiany konformacyjnej niezbędnej do połączenia podłoża. Jest to jeden z enzymów wyrażanych z większą obfitością w cytozolu wielu organizmów i wykonuje dodatkowe funkcje glikolityczne.
10- Quinasa piruvato
Druga fosforylacja na poziomie substratu, która zachodzi w glikolizy, jest katalizowana przez pirogronian kinazy, który jest odpowiedzialny za przeniesienie grupy fosforylowej fosfoenolpirii do ADP i wytwarzanie pirogronianu.
Ten enzym jest bardziej złożony niż którykolwiek z innych enzymów glikolitycznych, a u ssaków jest to enzym homotramalny (57 kDa/podjednostka). U kręgowców znajdują się co najmniej 4 izoenzymy: L (w wątrobie), R (w erytrocytach), M1 (w mięśniu i mózgu) i M2 (tkanki płodowe i tkanki dorosłe).
Fazy glikolizy (krok po kroku)
Trasa glikolityczna składa się z dziesięciu sekwencyjnych kroków i zaczyna się od cząsteczki glukozy. Podczas procesu cząsteczka glukozy jest „aktywowana” lub „przygotowywana” z dodaniem dwóch fosforanów, inwestując dwie cząsteczki ATP.
Następnie jest „wycięty” w dwóch fragmentach i jest ostatecznie modyfikowany chemicznie kilka razy, syntetyzujący, na drodze, cztery cząsteczki ATP, więc wzmocnienie netto trasy odpowiada dwóch cząsteczek ATP.
Z powyższego można wywnioskować, że droga jest podzielona na fazę „inwestycyjną”, fundamentalną dla całkowitego utleniania cząsteczki glukozy i kolejnej fazy „wzmocnienia” energii, w której początkowo zużyta energia jest uzupełniana, a dwa ATP netto netto netto Cząsteczki.
- Faza inwestycji energii
Oku. Jest to nieodwracalna reakcja i zależy od obecności jonów magnezu (MG2+):
Glukoza + ATP → glukoza 6-fosforan + ADP
W ten sposób wytworzona glukoza 2- 6-fosforanowa jest izomeryzowana do 6-fosforanowej fruktozy dzięki działaniu enzymu fosfoglukozy (PGI) (PGI) (PGI) (PGI) (PGI) (PGI) (PGI) (PGI). Jest to odwracalna reakcja i nie oznacza dodatkowego wydatku energetycznego:
6-fosforan glukozy → fruktoza 6-fosforan
3- Następnie kolejny etap inwestycji energetycznych implikuje fosforylację 6-fosforanu fruktozy z utworzeniem fruktozy 1,6-bifosforanu. Ta reakcja jest katalizowana przez enzym fosfofRutequinazę-1 (PFK-1). Podobnie jak pierwszy krok trasy, cząsteczka donatora grupy fosforanowej jest ATP, a także jest nieodwracalną reakcją.
Fruktoza 6-fosforan + ATP → Fruktoza 1,6-bifosforan + ADP
4- Na tym etapie glikolizy występuje katalityczne pęknięcie fruktozy 1,6-bifosforanu w fosforanach dihydroksyacetonu (DHAP) i 3-fosforanu gliceraldehydu (szczelina) Aldosa. Ta kondensacja aldoliczna jest katalizowana przez aldolazę enzymu i jest procesem odwracalnym.
Fruktoza 1,6-bifosforan → dihydroksyaceton fosforan + gliceraldehyd 3-fosforan
5- Ostatnia reakcja fazy inwestycji energii polega na interpretacji fosforanu DHAP triosasu i szczeliny katalizowanej przez enzym Izomerazę Triosa-fosforanu (TIM), fakt, że nie wymaga dodatkowego udziału energii, a także jest to odwracalny proces.
Fosforan dihydroksyacetonu ↔ gliceraldehydu 3-fosforan
- Faza zysku energii
6- 3-fosforanowy gliceraldehyd jest stosowany „w dół” na trasie glikolitycznej jako substratu do reakcji utleniania i innej fosforylacji, katalizowanej przez ten sam enzym, dehydrogenaza 3-fosforanu gliceraldehydowego (GAPDH).
Enzym katalizuje utlenianie węgla C1 cząsteczki do kwasu karboksylowego i fosforylację tego w tej samej pozycji, wytwarzając 1,3-bifoscynit. W trakcie reakcji 2 cząsteczki NAD+ są zmniejszone na cząsteczkę glukozy i stosuje się 2 nieorganiczne cząsteczki fosforanu.
Może ci służyć: tchawica2-gliceraldehyd 3-fosforan + 2NAD + + 2PI → 2 (1,3-bifosfogliceato) + 2NADH + 2H
W organizmach aerobowych każde NADH wytwarzane w ten sposób przechodzi przez łańcuch przenośnika elektronów, aby służyć jako substrat do syntezy 6 cząsteczek ATP z powodu fosforylacji oksydacyjnej.
7- Jest to pierwszy etap syntezy ATP w glikolizy i implikuje działanie kinazy fosfoglicerato (PGK) na 1,3-bifosfogliceniat, przenosząc grupę fosforylową (fosforylacja na poziomie substratu) z tej cząsteczki do cząsteczki ADP, daje 2atp 2atp i 2 cząsteczki 3-fosfoglikanu (3 pg) dla każdej cząsteczki glukozy.
2 (1,3-bifosfogliceato) + 2ADP → 2 (3-fosfoglicert) + 2ATP
8- 3-fosfoglicerynian służy jako substrat dla enzymu fosfoglicerato Mutasa (PGM), co czyni go 2-fosfoglikatą poprzez przemieszczenie grupy fosforylowej węgla 3 do węgla 2 za pomocą reakcji dwóch kroków, która jest odwracalna i zależna Jony magnezu (mg+2).
2 (3-fosfogliceryn) → 2 (2-fosfogliceryn)
9- Enzym w 2-fosfoglikinianie dehydrat i wytwarza fosfoenolpirwiakan (PEP) za pomocą reakcji, która nie zasługuje na dodanie dodatkowej energii i ma na celu wytworzenie związku o wysokiej energii, zdolnej do przekazania jego grupy fosforylowej w następnej reakcji.
2 (2-fosfoglicerynowe) → 2fosfoenolpirogronian
10-fosfoenolpiroguren jest substratem enzymu kinazy pirogronianowej (PYK), który jest odpowiedzialny za przeniesienie grupy fosforylowej w tej cząsteczce w kierunku cząsteczki ADP, tym samym, katalizując w ten sposób kolejną reakcję fosforylacji na poziomie podłoża.
W reakcji 2ATP i 2 cząsteczki pirogronianu powstają dla każdego glukozy, a obecność potasu i magnezu w postaci jonowej.
2fospo elplivato + 2adp → 2Pyrogronian + 2ATP
W ten sposób wydajność netto glikolizy składa się z 2ATP i 2NAD+ dla każdej cząsteczki glukozy, która wchodzi na trasę.
Jeśli są to komórki z metabolizmem tlenowym, to całkowita degradacja cząsteczki glukozy wytwarza od 30 do 32 ATP przez cykl Krebsa i łańcuch transportu elektronów.
Produkty glikolizy
Ogólna reakcja glikolizy jest następująca:
Glukoza + 2NAD + + 2ADP + 2PI → 2Pyrogronian + 2ATP + 2nadh + 2h+
Dlatego, jeśli zostanie krótko przeanalizowany, może zapewnić, że głównymi produktami trasy glikolitycznej są pirogronian, ATP, NADH i H.
Jednak cel metaboliczny każdego pośrednika reakcji zależy w dużym stopniu od potrzeb komórkowych, dlatego wszystkich pośredników można uznać za produkty reakcyjne, będąc w stanie je wyczuć w następujący sposób:
- 6-fosforan glukozy
- Fruktoza 6-fosforan
- Fruktoza 1,6-bifosforan
- Fosforan dihydroksyacetonu i 3-fosforan gliceraldehydu
- 1.3-bifosfogliceato
- 3-fosfoglicenit i 2-fosfoglikanu
- Fosfoenolpirogronian i pirogronian
Znaczenie
Chociaż sama glikoliza sama (może mówić o beztlenowej glikolizy) wytwarza tylko około 5% ATP, które można wyodrębnić z tlenowego katabolizmu glukozy, ta droga metaboliczna jest fundamentalna z kilku powodów:
- Służy jako „szybkie” źródło energii, szczególnie w sytuacjach, w których zwierzę musi szybko opuścić stan odpoczynku, dla którego procesy utleniania tlenowego nie byłyby wystarczająco szybkie.
- Na przykład szkieletowe „białe” włókna mięśniowe w ludzkim ciele są włókienami szybkiego skurczu i zależą od glikolizy beztlenowej.
- Kiedy z jakiegoś powodu komórka potrzebuje glikolityki.
- Wiele komórek zależy od glukozy jako źródła energii drogą glikolityczną, w tym Czerwone krwinki, Brak wewnętrznych organelli i komórek oczu (szczególnie tych z rogówki), które nie mają wielkiej gęstości mitochondriów.
Bibliografia
- Canback, ur., Andersson, s. G. I., I Kurland, C. G. (2002). Globalna filogeneza enzymów glikolitycznych. Materiały z National Academy of Sciences, 99 (9), 6097-6102.
- Chaudhry R, varacallo M. Biochemia, glikoliza. [Zaktualizowano 2019 AP 21]. W: StatPearls [Internet]. Treasure Island (FL): Publishing StatPearls; 2020 Jan-. Dostępne od: https: // www.NCBI.NLM.Nih.Gov/Books/NBK482303/
- Fothergill-Gilmore, L. DO., & Michels, p. DO. (1993). Ewolucja glikolizy. Postęp w biofizyce i biologii molekularnej, 59 (2), 105-235.
- Kim, J. W., & Dang, c. V. (2005). Wieloaspektowa role enzymów glikolitycznych. Trendy w naukach biochemicznych, 30 (3), 142-150.
- Kumari, a. (2017). Słodka biochemia: pamiętanie struktur, cykli i ścieżek przez mnemoniki. Academic Press.
- Li, x. B., Gu, J. D., & Zhou, Q. H. (2015). Przegląd glikolizy aerobowej i jej kluczowych enzymów-nowych celów terapii raka płuc. Rak klatki piersiowej, 6 (1), 17-24.
- « Charakterystyka zwierząt roślinożernych, typy, przykłady
- Charakterystyka wirusa mozaiki tytoniu, struktura, replikacja »

