Model gazu idealnego, zachowanie, przykłady
- 1164
- 332
- Paweł Malinowski
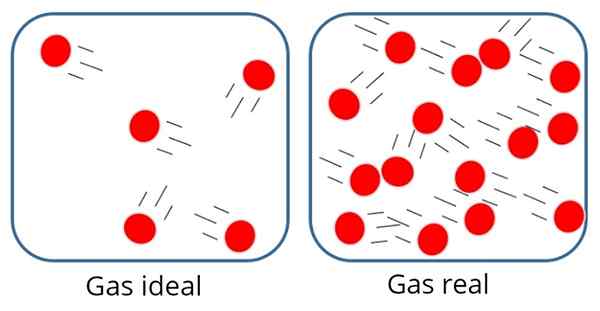
A Gaz doskonały albo Idealny gaz Jest to taki, w którym siła przyciągania lub odpychania molekularnego jest uważana za nieznaczącą między cząstkami, które ją tworzą, dlatego cała jej energia wewnętrzna jest kinetyczna, to znaczy energia związana z ruchem.
W takim gazie cząstki są zwykle dość daleko od siebie, chociaż czasami zderzają się ze sobą i ze ścianami pojemnika.
 W gazie idealnym cząstki są z dala od siebie
W gazie idealnym cząstki są z dala od siebie Z drugiej strony w gazie idealnym rozmiar lub masa cząstek nie ma znaczenia, ponieważ objętość zajmowana przez nich powinna być bardzo mała w porównaniu z objętością samego gazu.
Jest to oczywiście tylko podejście, ponieważ w rzeczywistości zawsze istnieje pewien stopień interakcji między atomami i cząsteczkami. Wiemy również, że cząstki zajmują przestrzeń i mają masę.
Jednak w wielu przypadkach założenia te działają całkiem dobrze, takie jak gazy o niskiej masie cząsteczkowej, w dobrym zakresie ciśnień i temperatur.
Jednak gazy o wysokiej masie cząsteczkowej, szczególnie przy wysokich ciśnieniach lub niskich temperaturach, w ogóle nie zachowują się jak gazy idealne i potrzebują innych modeli utworzonych w celu opisania ich z większą precyzją.
[TOC]
Pierwsze eksperymenty
Prawa rządzące gazami są empiryczne, to znaczy powstały z eksperymentów. Najbardziej godne uwagi eksperymenty przeprowadzono w siedemnastym, osiemnastym i na początku XIX wieku.
Po pierwsze, Robert Boyle (1627-1691) i Edme Mariotte (1620-1684), którzy niezależnie zmodyfikowali ciśnienie w gazie i zarejestrował zmianę tom, odkrycie, że były odwrotnie proporcjonalne: pod większym ciśnieniem, mniej objętości.
 Robert Boyle
Robert Boyle Ze swojej strony Jacques Charles (1746-1823) ustalił ten tom i temperatura Absolutny był bezpośrednio proporcjonalny, o ile ciśnienie pozostało stałe.
Może ci służyć: fale stacjonarne: wzory, cechy, typy, przykładyAmadeo Avogadro (1776–1856) odkrył, że dwie identyczne objętości różnych gazów zawierały tę samą ilość cząstek, o ile ciśnienie i temperatura były takie same. I wreszcie Joseph de Gay Lussac (1778–1850) powiedział, że utrzymując stałą objętość, ciśnienie w gazie jest wprost proporcjonalne do temperatury.
Prawa gazów idealnych
Te odkrycia są wyrażane przez proste formuły, wzywające P do presji, V do objętości, N do liczby cząstek i T Idealna temperatura gazu:
Boyle-Maleotte Law
Pod warunkiem, że temperatura jest ustalona, następują następujące:
P⋅V = stała
Charles Law
Gdy gaz jest pod stałym ciśnieniem:
V / t = stała
Gay Lussac Law
Utrzymanie gazu przy stałej objętości jest prawdą, że:
p / t = stała
Prawo Avogadro
Identyczne objętości gazu, w tych samych warunkach ciśnienia i temperatury mają taką samą liczbę cząstek. Dlatego możemy napisać:
V ∝ n
Gdzie n jest liczbą cząstek, a ∝ jest symbolem proporcjonalności.
Model gazu idealnego
Model gazu idealnego opisuje gaz, tak::
-Kiedy cząstki oddziałują na to przez bardzo krótki czas, poprzez elastyczne starcia, w których zachowuje się impuls i energia kinetyczna.
-Jego cząsteczki składowe są punktualne, innymi słowy, jej średnica jest znacznie niższa niż średnia odległość, którą podróżują między jednym a drugą kolizją.
-Siły międzycząsteczkowe nie istnieją.
-Energia kinetyczna jest proporcjonalna do temperatury.
Gazy monoatomowe - których atomy nie są ze sobą powiązane - i niska masa cząsteczkowa, w standardowych warunkach ciśnienia i temperatury (ciśnienie atmosferyczne i temperatura 0 º C), mają takie zachowanie, że model gazu idealnego jest bardzo dobrym opisem dla dla bardzo dobrego opisu dla ich.
Może ci służyć: vy canis majoris: odkrycie, cechy, struktura, szkolenie i ewolucjaIdealne równanie stanu gazu
Prawa powyższych gazów są łączone w celu utworzenia ogólnego równania, które reguluje idealne zachowanie gazu:
V ∝ n
V ∝ t
Dlatego:
V ∝ n⋅t
Ponadto, o prawie Boyle:
V = stała / p
Następnie możemy potwierdzić:
V = (stała x n⋅t) / p
Stała nazywa się stała gazu I jest to oznaczone literą r. Z tym wyborem równanie gazowe idealne wiąże cztery zmienne opisujące stan gazu, a mianowicie N, R, P i T, opuszczając:
P⋅v = n⋅r⋅t
To stosunkowo proste równanie jest zgodne z prawami gazów idealnych. Na przykład, jeśli temperatura jest stała, równanie jest zredukowane do prawa Boyle-Maleotte.
Stała gazu
Jak powiedzieliśmy wcześniej, w standardowych warunkach temperatury i ciśnienia, to znaczy w 0ºC (273.15 K) i 1 atmosfera ciśnieniowa, zachowanie wielu gazów jest blisko idealnego gazu. W tych warunkach objętość 1 molowego gazu wynosi 22.414 l.
W tym wypadku:
R = (p⋅V) / (n⋅t) = (1 atm x 22.414 l) / (1 mol x 273.15 K) = 0.0821 ATM ⋅ l /mol ⋅ k
Stałą gazu można również wyrazić w innych jednostkach, na przykład w systemie międzynarodowym, jeśli jest wart:
R = 8314 j⋅ mol-1⋅ k-1
Kiedy problem jest rozwiązywany poprzez prawo gazów idealnych, wygodnie jest zwrócić uwagę na jednostki, w których stała jest wyrażona, ponieważ, jak widzimy, istnieje wiele możliwości.
Zachowanie idealnego gazu
Jak powiedzieliśmy, każdy gaz w standardowych warunkach ciśnienia i temperatury, który ma niską masę cząsteczkową, zachowuje. Dlatego równanie p⋅v = n⋅r⋅t ma zastosowanie do znalezienia związku między czterema zmiennymi, które go opisują: n, p, v i t.
Może ci służyć: model atomowy HeisenbergaW ten sposób możemy sobie wyobrazić idealną część gazu zablokowaną w pojemniku i utworzona przez małe cząstki, które czasami zderzają się ze sobą i ze ścianami pojemnika, zawsze elastycznie.
To właśnie widzimy w następującej animacji porcji helu, szlachetnego i monoatomicznego gazu:
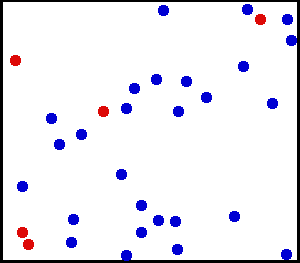 Hel jest szlachetnym gazem, w animacji część atomów helu jest pokazana w pojemniku. Czerwone służą do lepszego rozróżnienia ruchu. Źródło: Wikimedia Commons.
Hel jest szlachetnym gazem, w animacji część atomów helu jest pokazana w pojemniku. Czerwone służą do lepszego rozróżnienia ruchu. Źródło: Wikimedia Commons. Przykłady idealnych gazów
Gaz idealny jest hipotetycznym gazem, to znaczy jest idealizacją, jednak w praktyce wiele gazów zachowuje się w bardzo bliski sposób, co umożliwia precyzyjne model.
Gazy szlachetne
Przykładem gazów, które zachowują się jako ideały w standardowych warunkach, to gazy szlachetne, a także gazy lekkie: wodór, tlen i azot.
Balon aerostatyczny
 Model gazu idealnego wyjaśnia, w jaki sposób balon na gorące powietrze. Źródło: Wikimedia Commons.
Model gazu idealnego wyjaśnia, w jaki sposób balon na gorące powietrze. Źródło: Wikimedia Commons. Do aerostatycznego balonu na rycinie 1 może być zastosowane przez prawo Charlesa: gaz jest ogrzewany, dlatego powietrze wypełniające glob rozszerza się.
Balony helu
Hel jest, wraz z wodorem, najczęstszym elementem we wszechświecie, a jednak jest rzadki na ziemi. Ponieważ szlachetny gaz jest obojętny, w przeciwieństwie do wodoru, więc pełne balony helu są szeroko stosowane jako elementy dekoracyjne.
Bibliografia
- Atkins, str. 1999. Chemia fizyczna. Omega Editions.
- Chang, R. 2013. Chemia. 11va. Wydanie. MC Graw Hill Education.
- Cengel i. 2012. Termodynamika. 7. edycja. McGraw Hill.
- Cimbala, c. 2006. Mechanika płynów, podstaw i zastosowań. MC. Graw Hill.
- Giambattista, a. 2010. Fizyka. 2. Wyd. McGraw Hill.
- « Charakterystyka środowiska naturalnego, elementy, znaczenie, przykłady
- Przykłady i charakterystyki funkcji apelacyjnych »

