Jednostki siła jonowa, jak to obliczyć, przykłady

- 3101
- 463
- Eugenia Czapla
siła jonowa Jest to sposób na wyrażanie stężenia jonów w roztworze. Ta koncepcja została wprowadzona w 1922 roku przez Lewisa i Randalla podczas pracy nad opisem współczynnika aktywności chemicznej.
Gdy stężenie jonów w roztworze jest wysokie, powstaje elektrostatyczna interakcja między przeciwnymi jonami; To znaczy, kationów i anionów są bardzo przyciągane, co powoduje efektywne lub rzeczywiste stężenie jonowe jest mniejsze niż to obliczone dla określonej reakcji chemicznej.
 Jonowa siła wody morskiej jest wysoka, około 0.7, ze względu na jego wielkie stężenie rozpuszczonych soli
Jonowa siła wody morskiej jest wysoka, około 0.7, ze względu na jego wielkie stężenie rozpuszczonych soli Z tego powodu koncepcja aktywności chemicznej wprowadzono jako skuteczne stężenie jonowe roztworu, a aktywność chemiczna jest produktem molowości roztworu przez współczynnik aktywności chemicznej.
Ten współczynnik ma wartość zbliżoną do jednostki (1) dla rozcieńczonych roztworów jonowych i dla idealnych rozwiązań. Są to roztwory, w których interakcja międzycząsteczkowa między podobnymi cząsteczkami jest równa istnieniu między różnymi cząsteczkami.
Stworzenie koncepcji siły jonowej przyczyniło się do wyjaśnienia odchyleń od idealnego zachowania, obserwowane w prawdziwych roztworach jonowych.
[TOC]
Jednostki sił jonowych
Siła jonowa ma jako jednostki moli/l (molowość) lub mole/kg wody (moleality). To ostatnie jest zalecane w roztworach niedealnych, które są charakteryzowane, ponieważ objętości ich mieszanin nie są całkowicie dodatkami.
Oznacza to na przykład następujące: jeśli mieszane 0.5 litrów płynu A i 0.5 litrów cieczy B, wynikowa objętość tej mieszanki, niekoniecznie będzie równa 1 litrowi, ale może być inne.
Siła jonowa jest reprezentowana przez symbol i.
Może ci służyć: Butanal: Struktura, właściwości, zastosowania i ryzykoJak obliczyć siłę jonową?
Do obliczenia siły jonowej roztworu uwzględnia się stężenie wszystkich jonów obecnych w roztworze, a także ich odpowiednie wartości.
Wartość siły jonowej uzyskuje się poprzez zastosowanie następującego wzoru:
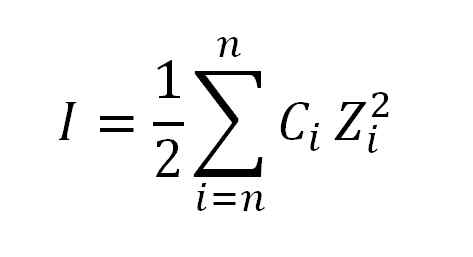 Wzór stosowany do obliczania siły jonowej. Źródło: Gabriel Bolívar.
Wzór stosowany do obliczania siły jonowej. Źródło: Gabriel Bolívar. Gdzie, jak już powiedziałem, jestem siłą jonową; C, odpowiada moralnemu stężeniu jonów lub moralnych; Podczas gdy Z reprezentuje ich odpowiednie wartości (± 1, ± 2, ± 3 itp.).
Wyrażenie, które pojawia się w wzorze w obliczaniu siły jonowej (σ) jest odczytywane jako podsumowanie, to znaczy suma iloczyn stężenia molowego (C) każdego jonu obecnego w roztworze przez jej walencję (z) Wysoki kwadrat.
Jak widać, wartość jonu ma największą wagę wartości jonowej siły roztworu. Na przykład: Valencia (z) Ca wynosi +2, więc Z2 To jest to samo 4. Tymczasem Walencja (z) Na es +1, a zatem z,2 To jest to samo 1.
To wskazuje, że wkład jonu CA2+ Do wartości siły jonowej, do tego samego stężenia jonowego trzonowca, jest ona czterokrotnie większa niż jon Na+.
Znaczenie siły jonowej
Siła jonowa jest odpowiednią miarą jonowego stężenia roztworu i jest podstawą ustalenia teorii Debyee-Hückel. Ta teoria opisuje idealne zachowanie rozwiązań jonowych.
Siła jonowa służy jako podstawa do obliczenia współczynnika aktywności (γSiema), parametr, który z kolei umożliwia obliczenie aktywności chemicznej związku jonowego, a aktywność chemiczna jest skutecznym i rzeczywistym stężeniem związku jonowego w roztworze.
Może ci służyć: aluminiowy octan (AL (CH3COO) 3): Struktura, właściwości, zastosowaniaPoprzez zwiększenie siły jonowej roztworu wzrasta interakcja między jonami. Dlatego zmniejsz γSiema i aktywność chemiczna jonów.
Wzrost siły jonowej może zmniejszyć rozpuszczalność białka w środowisku wodnym, przy czym ta właściwość jest wykorzystywana do wybitnego wytrącania białka. Do wytrącania i oczyszczania białek w osoczu stosuje się roztwory siarczanu jonowego siły jonowej.
Przykłady sił jonowych
Przykład 1
Oblicz siłę jonową roztworu chlorku potasu (KCl) 0.3 m.
KCL dysocjuje w następujący sposób:
KCl → k+ + Cl-
Mamy dwa jony: Kation K+ (Z =+1) i anion Cl- (Z = -1). Następnie stosujemy wzór, aby obliczyć siłę jonową i:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 11 + 0.3 m · 11]
= 0.3 m
Zauważ, że Walencja -1 Cl- Został przyjęty jako 1, jego wartość bezwzględna, ponieważ w przeciwnym razie siła jonowa byłaby równa 0.
Przykład 2
Obliczyć siłę jonową roztworu siarczanu wapnia (przypadek4) 0.5m
Walizka4 Odsuwa się w następujący sposób:
Sprawa4 → Ca2+ + południowy zachód42-
Mamy dwa jony: kation CA2+ (Z =+2) i SO Anion42- (Z = -2). Następnie stosujemy wzór, aby obliczyć siłę jonową i:
I = 1/2 [C · (+2)2 + C · (-2)2]
= 1/2 [0,5 m · 4 +0,5 m · 4]
= 2 m
Przykład 3
Oblicz siłę jonową amortyzatora z końcowymi stężeniami dibasowego fosforanu sodu (na2HPO4) 0.3 m i monobazowy fosforan sodu (nah2PO4) 0.4 m.
Następnie2HPO4 Odsuwa się w następujący sposób:
Może ci służyć: kwas arsenowy (H3SO4): właściwości, ryzyko i zastosowaniaNa2HPO4 → 2+ + HPO42-
Podczas gdy nah2PO4 Oddziela następujący wzór:
Nie2PO4 → na+ + H2PO4-
Postępujemy jako poprzednie ćwiczenia, tym razem mając aniony HPO42- (Z = -2) i h2PO4- (Z = -1):
I = 1/2 [C · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Zauważ, że stężenie NA+ z Na2HPO4 Jest mnożony przez 2, ponieważ jego stężenie jest podwójne. Jednak dla drugiej soli nie2PO4, Stężenie Na+ Tak, mnożymy go przez 1, zgodnie ze stechiometrią jego równania rozpuszczania.
Przykład 4
Oblicz siłę jonową roztworu chlorku sodu (NaCl) 0.15 m i glukoza (c6H12ALBO6) 0.3 m.
NaCl dysocjuje w następujący sposób:
NaCl → na+ + Cl-
Glukoza nie jest jednak zdysocjowana na jonach, ponieważ ma tylko wiązania typu kowalencyjne w swojej strukturze chemicznej. Dlatego Valencia de la glucosa (z) jest równa zero (0). Następnie obliczamy produkt siły jonowej NaCl:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2020). Siła jonów. Źródło: w:.Wikipedia.Lub
- Dr. David K. Ryan. (S.F.). Aktywność i siła jonowa klasa 4 Ryan. [PDF]. Źródło: Faculy.Uml.Edu
- University of Michigan. (S.F.). Bardziej szczegółowe spojrzenie na równowagę chemiczną. [PDF]. Odzyskane z: Umich.Edu
- Elsevier b.V. (2020). Siła jonów. Scientedirect. Pobrano z: Scientedirect.com
- C.D. Kennedy. (1990). Strona jonowa i dinsocjacja kwasów. [PDF]. Odzyskane z: iubmb.Biblioteka online.Wiley.com

