Fluor potasowy (kF)
- 3307
- 25
- Prokul Woliński
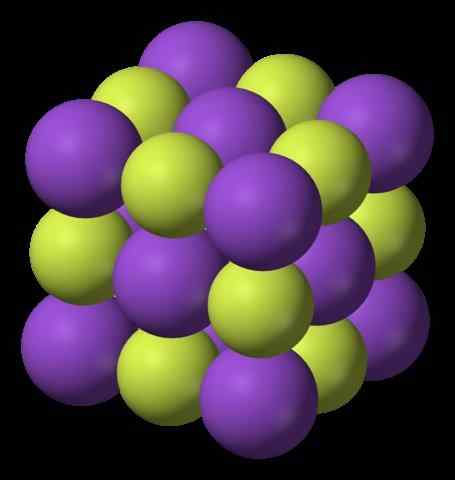
 Struktura fluoru potasu. Źródło: Benjah-BMM27, Wikimedia Commons
Struktura fluoru potasu. Źródło: Benjah-BMM27, Wikimedia Commons Co to jest fluor potasowy?On Fluor potasowy Jest to nieorganiczny halogened, który składa się z soli utworzonej między metalem a halogenem. Jego formuła chemiczna to kf, co oznacza, że dla każdego kationu k+ Jest F- odpowiednika. Interakcje są elektrostatyczne, w wyniku czego nie ma kowalencyjnych linków K-F.
Ta sól charakteryzuje się ekstremalną rozpuszczalnością w wodzie, więc tworzy nawilżanie, pochłania wilgoć i jest pyszna. Dlatego bardzo łatwo jest przygotować jego wodne roztwory, które służą jako źródło fluorkowych anionów dla wszystkich tych syntezy, w której pożądane jest włączenie go do jakiejś struktury.
KI jest wytwarzany przez reakcję węglanu potasu z kwasem fluorhorowym, wytwarzając bifluorek potasu (KHF2), który z powodu rozkładu termicznego powoduje fluor potasowy.
Struktura fluoru potasu
Górny obraz pokazuje strukturę fluoru potasowego. Fioletowe kule reprezentują kationy k+, Podczas gdy żółtawe kule reprezentują aniony f-.
Zauważ, że układ jest sześcienny i odpowiada strukturze soli GEMA, bardzo podobnej do układu chlorku sodu. Wszystkie sfery są otoczone sześcioma sąsiadami, które tworzą oktahedron KF6 lub fk6, to znaczy każdy k+ Otoczony jest sześć f-, I to samo dotyczy odwrotnie.
Wcześniej wspomniano, że KF jest higroskopijny, a zatem pochłania wilgotność środowiska. Zatem pokazane ustawienie odpowiadałoby bezwodnej postaci (bez wody), a nie jej hydratom, które pochłaniają tyle wody, które nawet rozpuszczają i „stopi” (Delicuescence).
Może ci służyć: neon: historia, właściwości, struktura, ryzyko, użyciaHydraty
Krystaliczne struktury hydratów stają się mniej proste. Ponieważ teraz cząsteczki wody interweniują bezpośrednio w układy i oddziałują z jonami K+ i f-. Jednym z najbardziej stabilnych hydratów to kf · 2H2O y kf · 4h2ALBO.
W obu hydratach nowo wymienione oktahedry są zdeformowane z powodu cząsteczek wody. Wynika to głównie z mostów wodoru między F- i h₂o (f--Hoh). Badania krystalograficzne wykazały, że pomimo tego dwa jony nadal utrzymują tę samą liczbę sąsiadów.
W rezultacie pierwotna struktura sześcienna bezwodnego fluorur potasu.
Anhydros dzielą przysmaki.
Właściwości fluorku potasu
- Waga molekularna: 58 097 g/mol.
- Wygląd fizyczny (kolor): Białe kryształy sześcienne lub przysmaki krystaliczny.
- Smak: ostry smak soli fizjologicznej.
- Punkt wrzenia: 2.741 ° F przy 760 mmHg (1502 ° C). W stanie ciekłym staje się przewodnikiem energii elektrycznej, chociaż aniony mogą- Nie współpracuj w tym samym stopniu do jazdy jak K+.
- Temperatura topnienia: 1.576 ° F; 858 ° C; 1131 K (KF Anhidro). Wskazuje to na jego silne linki jonowe.
- Rozpuszczalność: Rozpuszczalny w HF, ale nierozpuszczalny w alkoholu. To pokazuje, że wodór mosty między fluorkiem a alkoholiami, F--Hor, nie faworyzują procesu solwatacji przeciwko rozwiązaniu jego sieci krystalicznej.
- Rozpuszczalność w wodzie: bezwodne 92 g/100 ml (18 ° C); 102 g/100 ml (25 ° C); Dihydrain 349,3 g/100 ml (18 ° C). To znaczy, ponieważ KF jest uwodnione, staje się bardziej rozpuszczalny w wodzie.
- Gęstość: 2,48 g/cm3.
- Ciśnienie pary: 100 kPa (750 mm Hg) o 1.499 ° C.
- Rozkład: Kiedy jest podgrzewany do rozkładu, emituje toksyczny dym z tlenku potasu i fluoru wodoru.
- Działanie korozyjne: Wodny roztwór koroduje szkło i porcelanę.
- Temperatura zapłonu: To nie jest łatwopalna substancja
- Eksperymentalny wskaźnik refrakcji (ηd): 1.363.
- Stabilność: stabilny, jeśli jest chroniony przed wilgocią, ponieważ w przeciwnym razie substancja stała jest rozpuszczona. Niezgodne z silnymi kwasami i podstawami.
Zastosowanie fluorku potasu
- Dostosuj pH: Wodne roztwory fluorku potasu są stosowane w zastosowaniach i procesach przemysłowych. Na przykład roztwory KF pozwalają na dostosowanie pH w producentach przeprowadzanych w przetwarzaniu tekstylnym i pralniach (około 7).
- Źródło fluoru: Fluor potasowy jest po fluorku wodoru, głównym źródłem uzyskiwania fluoru. Ten pierwiastek jest stosowany w roślinach jądrowych i w produkcji związków nieorganicznych i organicznych, niektóre z zastosowaniami, takimi jak ich włączenie do zębatej.
- Synteza fluorokarbonu: Fluor potasowy może być stosowany w syntezie fluorbonu lub fluorkarbidu z chlorokarbonu, stosując reakcję finkeistein. W tej reakcji glikol etylenowy i dimetylosulfotlenek stosuje się jako rozpuszczalniki.
- Fluorowanie: Podobnie jak źródło fluorowe, w którym leży rozpuszczone w wodzie, z ich roztworów mogą syntetyzować złożone fluorki, to znaczy są włączone do F- do struktur. Przykładem jest następujące równanie chemiczne:
Mnbr2(AC) + 3KF (ac) => kmnf3(s) + 2KBR (AC)
- Następnie wytrąca mieszany fluor KMNF3. W ten sposób można dodać F- być częścią złożonej soli metalowej. Oprócz manganu fluorki innych metali mogą się spieszyć: KCOF3, Kfef3, Nóż3, KCF3 i KZNF3.
- Podobnie fluorek można kowalencyjnie włączyć do aromatycznego pierścienia, syntetyzując organizację.
- Kilka: KF jest stosowany jako materiał pośredni lub surowy do syntezy związków, które są stosowane głównie w produktach agrochemii lub pestycydów.
- Ponadto jest używany jako środek założyciel spoiny.
Bibliografia
- Fluor potasowy. Odzyskany z chemicznej książki.com.
- Fluor potasowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.

