Struktura fluorku litowego, właściwości, uzyskiwanie, zastosowania

- 1384
- 90
- Herbert Wróblewski
On Fluor litowy Jest to nieorganiczna substancja stała, której formuła chemiczna to LIF. Jest utworzony przez jony li+ i f- które są zjednoczone poprzez więź jonową. Występuje w małych ilościach w kilku minerałach, zwłaszcza krzemianach, takich jak lepidolit, woda morska i w wielu studzienkach mineralnych.
Miał szerokie zastosowanie na urządzeniach optycznych ze względu na jego przezroczystość w szerokim zakresie długości fal, od widma podczerwieni (IR) do ultrafioletu UV, przez widzialny.
 Lepidolit, minerał zawierający niewielkie ilości fluorku Lifal. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Lepidolit, minerał zawierający niewielkie ilości fluorku Lifal. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Został również stosowany na urządzeniach do wykrywania niebezpiecznego promieniowania w pracy, w których ludzie są na nich narażeni przez krótki czas. Ponadto jest stosowany jako materiał do stopienia aluminium lub do robienia szklanek lub szklanek szkła i ceramicznego produkcji.
Służy jako materiał do pokrycia komponentów baterii litowych i zapobieganie początkowej utraty obciążenia ich.
[TOC]
Struktura
Fluorek litowy jest związkiem jonowym, to znaczy utworzonym przez połączenie kationu+ i anion f-. Siła, która je utrzymuje, jest elektrostatyczna i nazywa się wiązaniem jonowym.
Kiedy lit jest łączony, daje elektron fluorku, oba są bardziej stabilne niż początkowe sposób, jak wyjaśniono poniżej.
Element litowy ma następującą konfigurację elektroniczną: [He] 1s2 2s1 A podczas podawania elektronu struktura elektroniczna jest taka: [on] 1s2 który jest znacznie bardziej stabilny.
Element fluoru, którego konfiguracja elektroniczna to: [ne] 1s2 2s2 2 p5, Akceptując elektron jest formą [ne] 1s2 2s2 2 p6, bardziej stabilny.
Nomenklatura
- Fluor litowy
- Fluorolitio
Może ci służyć: tlenki nie -metalowe- Monofluorek litowy
Nieruchomości
Stan fizyczny
Białe ciało stałe, które krystalizuje w strukturze sześciennej, takiej jak chlorek sodu nacl.
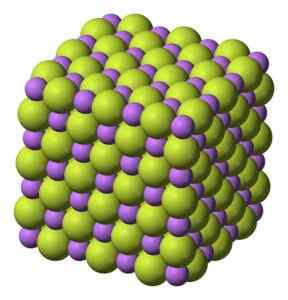 Sześcienna struktura kryształów litowych litowych. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Sześcienna struktura kryształów litowych litowych. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Waga molekularna
26 g/mol
Temperatura topnienia
848,2 ºC
Punkt wrzenia
1673 °
Gęstość
2640 g/cm3
Współczynnik załamania światła
1 3915
Rozpuszczalność
Niewielki rozpuszczalny w wodzie: 0,27 g/100 g wody w 18 ° C; 0,134 g/100 g w 25 ° C. Rozpuszczalne w kwaśnej pożywce. Nierozpuszczalny w alkoholu.
Inne właściwości
Jego opary mają gatunki dimic (LIF)2 i Trimeric (LIF)3. Z kwasem fluorhorowym HF forma litowa litowa2; Z wodorotlenkiem litu tworzy sól podwójną.Lioh.
Uzyskanie i lokalizacja
Fluorek litowy Lif można uzyskać przez reakcję między kwasem fluorhorowym HF a wodorotlekiem litowym litowym litowym lub litowym węglanem litowym litowym2WSPÓŁ3.
Jest jednak obecny w małych ilościach w niektórych minerałach, takich jak lepidolit i woda morska.
 Fluor litowy występuje w małych ilościach w wodzie morskiej. Adeeb Atwan [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons.
Fluor litowy występuje w małych ilościach w wodzie morskiej. Adeeb Atwan [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons. Aplikacje
W zastosowaniach optycznych
LIF jest stosowany w postaci kompaktowych kryształów w spektrofotometrach podczerwieni (IR) z powodu doskonałej dyspersji, jaką mają w przedziale długości fali między 4000 a 1600 cm-1.
Kryształy Lif Lif są uzyskiwane z nasyconych roztworów z tej soli. Może zastąpić naturalne kryształy fluorytowe w różnych typach urządzeń optycznych.
Duże i czyste kryształy są stosowane w układach optycznych do światła ultrafioletowego (UV), widzialnych i IR i rentgenowskiego monochromatory (0,03-0,38 nm).
 Life Lif Fluoruro Crystal, wewnątrz zlewki. V1adis1av [domena publiczna]. Źródło: Wikimedia Commons.
Life Lif Fluoruro Crystal, wewnątrz zlewki. V1adis1av [domena publiczna]. Źródło: Wikimedia Commons. Jest również stosowany jako materiał powłoki optyczny dla regionu UV ze względu na jego szeroki pasmo optyczne, większe niż w przypadku innych metalowych fluorków.
Może ci służyć: metale alkaliczneJego przejrzystość w odległym UV (90-200 nm) sprawia, że jest idealna jako powłoka ochronna w lusterach aluminiowych (AL). LIF/Al Mirrors ma zastosowanie w systemach teleskopów optycznych do zastosowań kosmicznych.
Powłoki te są osiągane przez fizyczne osadzanie się odkładania pary i warstwy na poziomie atomowym.
W jonizujących lub niebezpiecznych detektorach promieniowania
Fluorek litowy był szeroko stosowany w detektorach termoluminescencyjnych dla fotonów, promieniowania neutronowego i β (beta).
Detektory termoluminescencyjne zachowują energię promieniowania po narażeniu na to. Następnie podczas ich ogrzewania uwalniają energię przechowywaną w formie światła.
W przypadku tego zastosowania LIF jest ogólnie datowany z zanieczyszczeniami magnezowymi (Mg) i tytanem (Ti). Zanieczyszczenia te wytwarzają pewne poziomy energii, które działają jak otwory, w których elektrony uwalniane przez promieniowanie są uwięzione. Kiedy materiał następnie ogrzewał, elektrony te wracają do pierwotnego światła emitującego stan energetyki.
Intensywność emitowanego światła zależy bezpośrednio od energii pochłanionej przez materiał.
Termoluminescencyjne detektory LIF zostały pomyślnie przetestowane w celu pomiaru złożonych pól promieniowania, takich jak te obecne na dużym zderzeniu hadronowym lub LHC (dla jego akronimu dla angielskiego Duży zderzak hadronowy), zlokalizowana w Europejskiej Organizacji Badań Nuklearnych, znana jako CERN (dla akronimu francuskiego Conseil Européen polej nukleaire recherche).
Promieniowanie w doświadczeniach przeprowadzonych w tym centrum badawczym prezentuje hadrony, neutrony i elektrony/pozytry, wśród innych rodzajów cząstek subatomowych, z których wszystkie można wykryć za pomocą LIF.
Jako materiał do wstępnej katody baterii litowej
LIF został pomyślnie przetestowany w postaci nanokompozytów z kobaltem (CO) i żelazem (wiara) jako materiałów do wstępnej Wstępność) z materiału katody litowej -ion.
Może ci służyć: eter etylowyPodczas pierwszego cyklu obciążenia lub stadium tworzenia akumulatora litowo -jonowego organiczny elektrolit jest rozkładany, tworząc fazę stałą na powierzchni anody.
Proces ten zużywa lit katody i zmniejsza energię między 5 do 20% całkowitej pojemności akumulatora litowo -jonowego.
Z tego powodu zbadano elektrochemiczne wstępność katody, która generuje elektrochemiczną ekstrakcję litu nanokomponowanego, który działa jako dawca litu, unikając w ten sposób spożywania litu katode.
Nanokompozyty LIF/CO i Lif/Fe mają dużą pojemność do przekazywania litu na katodę, jest łatwy do syntezy, stabilny w warunkach przetwarzania środowiska i baterii.
 Bateria litowo-jonowa. Autor: MR.ちゅら さん. Litowa_battery * Dzień fotografii, sierpień 2005 * Person Fotography Person Aney. Źródło: Wikimedia Commons.
Bateria litowo-jonowa. Autor: MR.ちゅら さん. Litowa_battery * Dzień fotografii, sierpień 2005 * Person Fotography Person Aney. Źródło: Wikimedia Commons. W kilku zastosowaniach
Fluorek litowy jest stosowany jako miernik spawania, zwłaszcza aluminium i w powłokach prętów spawalniczych. Jest również stosowany w komórkach redukcji glinu.
Jest szeroko stosowany w produkcji szkła (takich jak soczewki), w którym spada współczynnik rozszerzania. Jest również stosowany w produkcji ceramiki. Ponadto ma zastosowanie do produkcji szklików i szklistości.
LIF jest składnikiem paliwowym rakiet i paliw dla niektórych rodzajów reaktorów.
LIF jest również stosowany w diodach emitujących światło lub składnikach fotowoltaicznych do wstrzyknięcia elektronów do warstw wewnętrznych.
Bibliografia
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- LUB.S. National Library of Medicine. (2019). Lit fluoru. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov.
- Obryk, ur. i in. (2008). Odpowiedź różnych rodzajów detektorów fluorku litowego TL na mieszane pól promieniowania o wysokiej temperaturze. Pomiary promieniowania 43 (2008) 1144-1148. Odzyskane z naukowym.com.
- Słońce i. i in. (2016). W miejscu chemicznym syntezy litu/nanokompozytu fluorku/metalu w celu wstępnej wstępnej wstępnej wydajności katod. Nano Letters 2016, 16, 2, 1497-1501. Odzyskane z pubów.ACS.org.
- Hennessy, J. i Nikzad, s. (2018). Odkładanie warstwy atomowej powłok optycznych fluorku litowego dla ultrafioletu. Inorganics 2018, 6, 46. MDPI odzyskało.com.
- « 10 eksperymentów naukowych dotyczących fizycznej wtórnej, chemii, biologii
- Struktura kwasu metylomalonowego, właściwości, synteza, »

