Struktura cyny, właściwości, uzyskiwanie, użycia

- 1515
- 454
- Matylda Duda
On cyna Jest to metal należący do bloku P stolika okresowego, którego symbolem chemicznym jest SN, a który znajduje się w grupie 14, węgiel. Pomimo tego, że jest powszechnie używanym metalem przez ludzkość od czasów starożytnych, prawda jest taka, że jest to rzadki metal w skorupie Ziemi (2.3 ppm).
Jest to srebrny, miękki, plastyczny i plastyczny metal. Ma liczbę atomową 50, a jego dominujące stany lub liczby utleniania wynoszą +2 (Sn2+) i +4 (Sn4+), Będąc związkami cyny (II), takie jak SNCL2, Dobre środki redukujące.
 Alotropy cyny. Źródło: Zinn_9.JPG: Od: Użytkownik: Tomihahndorf.Praca pochodna: MaterialScientist/CC BY-S (https: // creativeCommons.ORG/Licencje/BY-SA/2.0)
Alotropy cyny. Źródło: Zinn_9.JPG: Od: Użytkownik: Tomihahndorf.Praca pochodna: MaterialScientist/CC BY-S (https: // creativeCommons.ORG/Licencje/BY-SA/2.0) Puszka ma jako symbol SN, który jest skrótem łacińskiego słowa „Stannum”. Tin jest metalowym odpornym na atak wodny i powietrze w temperaturze pokojowej; Ale w gorącym powietrzu tworzy dwutlenek cyny, Snam2.
Właściwość bycia odpornym na korozję i posiadanie niskiego tempa topnienia służyła do wielu zastosowań; takie jak powłoka metali powierzchni i spawanie.
Cyna ma dwie główne formy alotropowe: biały i stały kształt β; oraz α, szary i normalnie zakurzone konteksty (bardziej kruche). Dlatego postać β jest najczęściej używana w aplikacjach TIN.
Kolejną ważną właściwością cyny jest zdolność do bycia częścią stopów z kilkoma metali.
[TOC]
Odkrycie
 Granulki blaszane. Źródło: Nephronus, CC0, Via Wikimedia Commons
Granulki blaszane. Źródło: Nephronus, CC0, Via Wikimedia Commons Tin to metal znany od czasów starożytnych. Dlatego nie wiadomo, kto był jego odkrywcą; I tym mniej, rok i miejsce jego odkrycia.
Brąz to stop z miedzi z cyną i arsenką. Możliwe jest, że opracowanie tego stopu jest konsekwencją przypadkowego i niezamierzonego faktu, ponieważ pierwsze obiekty brązu - w epoce brązu - zostały utworzone przez miedź i tylko ślady arsenu.
Te obiekty pojawiły się na Bliskim Wschodzie, gdzie arsen jest związany z miedzią. Ale od samego początku toksyczność arsenu została udowodniona, osiągając jego wymianę2).
Starożytni Grecy otrzymali puszkę przez handel morski i nazywali źródło ich puszki „kasiteridami”, co oznacza „wyspy cynowe”. Możliwe, że wyspy te znajdowały się w Corneelles, Brytyjczycy lub Hiszpanii, gdzie znajdują się duże złoża cyny.
Może ci służyć: subaliicelan Bismuth: struktura, właściwości, zastosowania, efektyChemiczna struktura cyny
Gdy istnieją dwa alotropy: biała cyna lub β-SN i szara cyna lub α-SN, będziemy mieli dwie struktury krystaliczne. Β-SN jest tetragonalny wyśrodkowany na ciele (BCT), który charakteryzuje plastyczność białej cyny.
Tymczasem struktura α-SN jest diamentem; Oznacza to, że atomy SN są połączone tworząc sieci tetrahedra, bez istnienia wiązania metalowego.
Cyna przedstawia również dwa inne alotropy w różnych warunkach ciśnienia (w rzędu GPA) i temperatury (powyżej 161 ° C): σ-SN i γ-SN.
Elektroniczna Konfiguracja
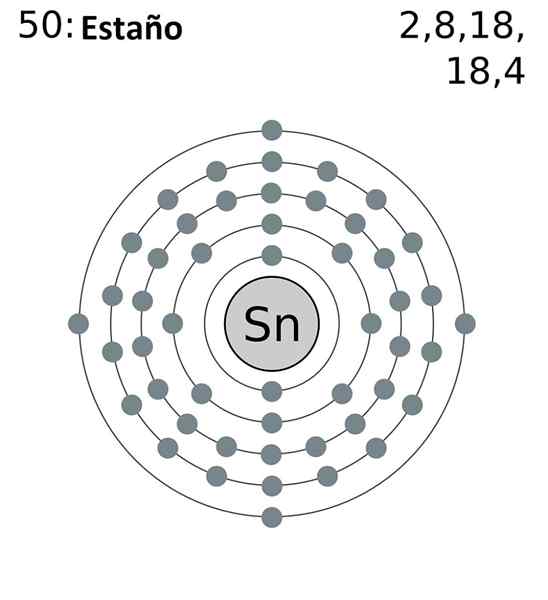
Tin skrócona konfiguracja elektroniczna jest następująca:
[Kr] 4d10 5s2 5 p2
Dodając wszystkie elektrony, będziemy mieli w sumie 14, tę samą liczbę, która odpowiada Twojej grupie. Jednak tylko elektrony orbitali 5s i 5p to te, które uczestniczą w reakcjach chemicznych puszki, ponieważ w przypadku 4D nie są energetycznie dostępne.
Właściwości cyny
Wygląd i cechy fizyczne
Tin jest miękkim, plastycznym i plastycznym metalem, który może być zimny i wirujący. Jego niska temperatura topnienia pozwala przylegać do czyszczenia powierzchni metali lub stopów, takich jak stal, miedź i stopy, chroniąc je przed utlenianiem.
Kiedy kawałek blaszania jest złożony, przecina, emitując charakterystyczny dźwięk znany jako „krzyk cyny”, konsekwencja kruszenia kryształów.
TIN ma dwie postacie alotropowe: β i α. Forma β odpowiada białej substancji stałej i jest odpowiedzialna za zastosowania cyny; Podczas gdy forma α jest szarawym proszkiem.
 Lokalizacja cyny w stole okresowym. Źródło: Image Daniel Mayer lub Greatpatton i wydane pod względem FDL GNU
Lokalizacja cyny w stole okresowym. Źródło: Image Daniel Mayer lub Greatpatton i wydane pod względem FDL GNU Postać β jest prezentowana w temperaturach powyżej 13.2 ° C. Gdy temperatura spada 13.2 ° C, cyna zmienia się z β do postaci α. Zjawisko to jest niepożądane i unika się dodawania innych metali do cyny, takich jak antymon lub bizmut, które blokują tę zmianę i przedłużając jej okres użytkowania.
Tin jest pierwszym nadprzewodnikiem znanym w temperaturach poniżej 3.72 K.
Liczba atomowa
pięćdziesiąt
Masa cząsteczkowa
118.71 g/mol
Temperatura topnienia
231.93 ° C
Punkt wrzenia
2602 ºC
Gęstość
Alotropo β: 7.265 g/cm3
Alotropo α: 5.769 g/cm3
Stany utleniania
Cyna ma wiele stanów utleniania: -4, -3, -2, -1, 0, +1, +2, +3, +4. Jednak większość ich związków ma puszkę ze stanami utleniania +2 (Sn2+) i +4 (Sn4+).
Może ci służyć: związki organiczneEnergie jonizacyjne
Po pierwsze: 708.6 kJ/mol
Drugi: 1411.8 kJ/mol
Po trzecie: 2943.0 kJ/mol
Elektronialiczność
1.96 na skali Pauling
Reaktywność
Cyna jest metalową odporną na działanie powietrza i wody w temperaturze pokojowej, ale gdy jest podgrzewana w powietrzu, tworzy tlenek cyny (IV), SRęczy2, który jest słabo kwaśny. Jest atakowany przez kwasy i alkalis, a w obecności tlenu może działać w niektórych przypadkach jako katalizator.
Uzyskanie
 Casiterit Mineral jest głównym źródłem mineralogicznym cyny. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/cc by-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)
Casiterit Mineral jest głównym źródłem mineralogicznym cyny. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/cc by-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Puszka, z punktu widzenia jego występowania, jest rzadkim metalem, ponieważ ma obfitość w kory Ziemi wynoszącej zaledwie 2 ppm. Casiterit Mineral, minerał tlenku cyny, jest jedynym komercyjnym źródłem cyny.
Casiterite to czarno -minerał znaleziony na błotnistym terenie na brzegach rzek. Cyna jest wydobywana z kasiteritów przez rozgrzanie do 1370 ° C za pomocą węgla lub coli w celu uzyskania jego redukcji.
Wytworzona cyna jest nieczysta, więc jest leczona wodorotlenkiem sodu lub kwasem solowym w celu solubilizacji cyny. Następnie podlega to elektrolizy, będąc anodą cyny i żelazną katodą. Puszka jest osadzona na katodzie, z czystością większą niż 90%.
Używa/aplikacje
Ochrona przed korozją
Cyna to metal odporny na korozję. SO -SO -CALED CAN lub TIN to stalowy pojemnik, pokryty warstwą cyny, aby uniknąć utleniania.
Puszki były używane do przechowywania żywności i innych substancji, na przykład: obrazy, lakiery, rozpuszczalniki itp. Ale obecnie są one zastępowane przez pojemniki aluminiowe lub plastikowe. Rury i zawory pokryte cyną utrzymują czystość wody i napojów.
Stopy
 Pierwszymi zastosowaniami stopów cyny było produkcja pojemników lub przyborów, takich jak puszki i dzbanki tej spiżarni. Źródło: Butterfly Voyages - Serge Ouachée/CC przez -sa (https: // creativeCommons.Org/licencje/by-sa/3.0)
Pierwszymi zastosowaniami stopów cyny było produkcja pojemników lub przyborów, takich jak puszki i dzbanki tej spiżarni. Źródło: Butterfly Voyages - Serge Ouachée/CC przez -sa (https: // creativeCommons.Org/licencje/by-sa/3.0) Mężczyzna zaczął używać brązu przez ponad 5000 lat. Brąz to stop z miedzi i puszki używanej w opracowaniu narzędzi, broni, przyborów domowych.
W ten sam sposób skórka, stop, który początkowo był cyny i ołowiu, został użyty do robienia doniczek, płyt itp. Ale ze względu na toksyczność ołowiu, Peel jest obecnie produkowany z cyny, antymonu i stopu kobaltu.
Może ci służyć: hipoodous kwas (Hio)Topia cyny i ołowiu ma niską temperaturę topnienia, która pozwoliła na jego stosowanie w spawaniu, technikę, która służy do składania elementów obecnych w obwodach elektrycznych i elektronicznych. Istnieją samochody, w których puszka jest stopem z żelazem, podczas gdy są one stosowane w aluminium, puszce i tytan.
Stopy okrągłe, zwane również cyrkaloyami, są stosowane w reaktorach jądrowych i mają niewielką ilość cyny.
 Próbki cyny. Źródło: Ondřej Mang, domena publiczna, przez Wikimedia Commons
Próbki cyny. Źródło: Ondřej Mang, domena publiczna, przez Wikimedia Commons Stop srebra i cyny został użyty w amalgamatach dentystycznych.
Krystaliczny stop z elementem Niobio to nadprzewodniczący, który działa w temperaturze 18 K i utrzymuje swoją właściwość w silnym polu magnetycznym.
Szkło
Puszka jest używana w procedurze Pilkington do produkcji szkła okiennego. Stopone szkło jest umieszczane na stopionej powierzchni blaszanej, zdobywając szkło płaską i gładką powierzchnię. Ta technika jest nadal z powodzeniem stosowana.
Sole blaszane są spryskiwane na szkło, aby uzyskać podszewkę mocy przewodzącej, będąc w stanie użyć paneli oświetleniowych i przedniej szyby bez mrozu.
Związki cyny
Grzeszny chlorek (SNCL2) Jest stosowany w cynach ocynkowanej i jako środek redukujący w produkcji polimerów i barwników. Fluor cyny (SNF2) Jest to aktywny składnik w pastach dentystycznych.
Tymczasem jego tlenek jest użytecznym katalizatorem w niektórych procesach przemysłowych. Ponadto jest stosowany jako proszek do polerowania stali.
Organiczne związki cyny są stosowane jako biocidy i fungicydy, są toksyczne dla ludzi. Organiczne stabilizatory cyny są stosowane w celu zapobiegania zmianom w chlorku poliwinylu z powodu ekspozycji na światło i ciepło.
Chlorek Isñico (SNCL4) jest używany jako stabilizator perfum i jako materiał wyjściowy dla innych soli blaszanych.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Cyna. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information (2020). Cyna. Podsumowanie Pubchem Comunund dla CID 23974. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Dr. Doug Stewart. (2020). Fakty elementów blaszanych. Odzyskane z: Chemicool.com
- Redaktorzy Enyclopaedia Britannica. (2020). Cyna. Odzyskane z: Britannica.com
- Bell, Terence. (26 sierpnia 2020). Właściwości, produkcja i zastosowania cyny. Odzyskane z: Thoughtco.com
- Lentech b.V. (2020). Cyna. Odzyskane z: lentech.com
- Stephanie Pupas. (28 lipca 2015 r.). Fakty o puszce. Odzyskane z: Livescience.com
- Postępowanie konferencyjne AIP. (9 lutego 2018 r.). Odzyskiwanie cyny po żużlu cyny za pomocą metody elektrolizy. doi.Org/10.1063/1.5024070

