Charakterystyka stanu gazowego, prawo ogólne, przykłady

- 2253
- 449
- Pani Gilbert Stolarczyk
On Stan gazowy Jest to stan agregacji podmiotu, w którym cząstki są przechowywane razem przez słabe interakcje, będąc w stanie poruszać się przez wszystkie kierunki zawierającego je pojemnika. Ze wszystkich fizycznych stanów podmiotu Gaseous jest tym, który przejawia największą wolność i chaos.
Gazy wywierają ciśnienie, ciepło transportowe i składają się z dowolnego rodzaju małych cząstek. Nasza atmosfera i powietrze, które oddychamy, są przejawem stanu gazowego tutaj na Ziemi.
 W emanacji dymu zachowanie gazów można zaobserwować, zanim rozproszyły się one przez atmosferę. Źródło: Pexels.
W emanacji dymu zachowanie gazów można zaobserwować, zanim rozproszyły się one przez atmosferę. Źródło: Pexels. Przykładami gazu są gazy cieplarniane, takie jak para wodna, dwutlenek węgla, metan lub ozon. Dwutlenek węgla, który wydychamy w oddychaniu, jest kolejnym przykładem substancji gazowej.
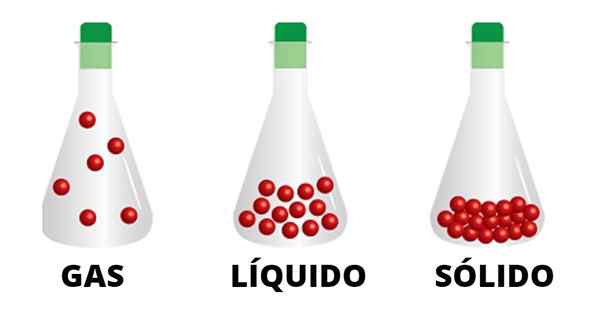 Cząstki gazowe są połączone słabymi interakcjami i poruszają się przez pojemnik. Zaobserwowano, że cząstki stanu ciekł
Cząstki gazowe są połączone słabymi interakcjami i poruszają się przez pojemnik. Zaobserwowano, że cząstki stanu ciekł Na przykład ciecze i substancje stałe nie przejdą do pozycji poza ich własnymi granicami, co nie zdarza się w przypadku gazów. Dym papierosów, kominów i wież, pokazuje, jak gaz wznoszący się i rozproszony przez środowisko, nie zatrzymując go.
[TOC]
Charakterystyka stanu gazowego
Brakuje objętości lub kształtu
Stan gazowy charakteryzuje się brakiem zdefiniowanej formy lub objętości. Jeśli nie ma granic, aby go zachować, rozproszy się w całej atmosferze. Nawet jak w przypadku helu, ucieknie poza Ziemię.
Gaz może tylko zdobyć kształt narzucony przez pojemnik. Jeśli pojemnik jest cylindryczny, gaz „będzie miał” kształt cylindra.
Może ci służyć: kalorymetria: jakie badania i zastosowaniaZły kierowca ciepła
Stan ten charakteryzuje się również złym przewodnikiem zarówno ciepła, jak i elektryczności. Zasadniczo jest mniej gęsty w porównaniu do stanów stałych i cieczy.
Ponieważ większość gazów jest bezbarwna, taka jak tlen i dwutlenek węgla, można ustalić, ile z nich jest w pojemniku za pomocą miary ich ciśnienia.
Odczynniki
Gazy są zwykle bardziej reaktywne, z wyjątkiem gazów szlachetnych niż cieczy lub ciał stały.
Małe cząsteczki
Cząstki gazowe są również zwykle małe, to atomy lub proste cząsteczki.
Na przykład, gazowy wodór, h2, Jest to bardzo mała cząsteczka utworzona przez dwa atomy wodoru. Mamy też hel, on, którego atomy są jeszcze mniejsze.
Interakcje
Interakcje w stanie gazowym są nikczemne. To bardzo różni się od stanów cieczy i stałych, w których ich cząsteczki są bardzo spójne i silnie oddziałują od siebie. W cząsteczkach tworzących stany ciekłe i stałe nie ma wśród nich żadnej pustki molekularnej.
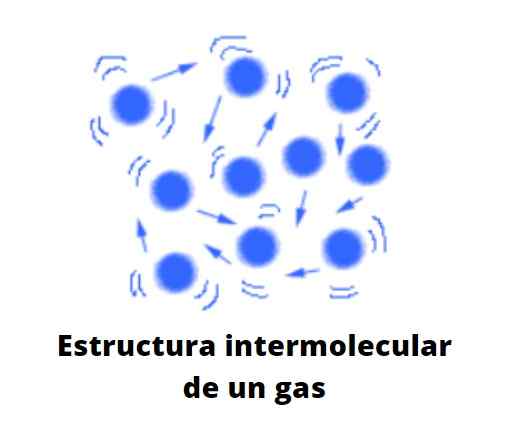
Cząstki w stanie gazowym są bardzo dystansowe jeden z innych, wśród nich jest wiele pustki. Nie jest to już próżnia w skali molekularnej. Odległość, która je oddziela, jest tak duża, że każda cząstka w gazie jest wolna, obojętna na otoczenie, chyba że w chaotycznej trajektorii nie zderzają się z inną cząsteczką lub pod ścianą pojemnika.
Może ci służyć: rozcieńczone rozwiązanieJeśli zakłada się, że nie ma pojemnika, pustka między cząsteczkami gazu może być zajęta przez powietrze, która popycha i przeciąga gaz w kierunku jego prądu. Dlatego powietrze, które składa się z gazowej mieszaniny, jest zdolne do deformowania i rozprzestrzeniania substancji gazowych, o ile nie są one bardziej gęstsze niż on.
Ogólne prawo gazowe
Eksperymentalne badanie zachowania i mechaniki gazów spowodowało kilka praw (Boyle, Charles, Gay-Lussac), które łączą się w celu przewidywania parametrów dowolnego systemu lub zjawiska gazu, to znaczy, jaka będzie jego temperatura, objętość, objętość i ciśnienie.
To ogólne prawo ma następujące wyrażenie matematyczne:
P = kt/v
Gdzie k jest stałym, p ciśnieniem i objętością, a t temperaturę gazu w skali Kelvina. Zatem znajomość dwóch zmiennych (powiedzieć, p i v), trzeci można wyczyścić, co byłoby nieznane (t).
To prawo zezwala na przykład, jaka powinna być temperatura gazu, zablokowana w pojemniku objętościowym, aby wyświetlić ciśnienie p.
Jeśli dodamy wkład Amadeus Avogadro w to prawo, będziemy wtedy mieli prawo gazów idealnych, które obejmuje również liczbę cząstek, a wraz z nimi stężenie molowe gazu:
P = nrt/v
Gdzie N odpowiada liczbie moli gazu. Równanie można przepisać jako:
P = Crt
Gdzie C Jest to stężenie molowe gazu (N/V). Zatem z ogólnego prawa uzyskuje się idealne prawo, które opisuje, w jaki sposób odpowiada ciśnienie, stężenie, temperatura i objętość gazu idealnego.
Może ci służyć: SiftedPrzykłady stanu gazowego
Elementy gazowe
Ten sam okresowy tabela oferuje dobry repertuar przykładów elementów prezentowanych na Ziemi jako gaz. Między nimi mamy:
-Wodór

-Hel
-Azot
-Tlen
-Fluor
-Chlor
-Neon
-Argon
-Kripton
-Ksenon
Nie oznacza to, że inne elementy nie mogą stać się gazowe. Na przykład metale można przekształcić w gazy, jeśli są poddawane wyższym temperaturom niż odpowiednie temperatury wrzenia. Zatem mogą znajdować się gazy żelaza, rtęci, srebra, złota, miedzi, obwodowej, irydowej, cząstek Osmio; dowolnego metalu.
Związki gazowe
Na poniższej liście mamy kilka przykładów związków gazowych:
-Tlenek węgla, co
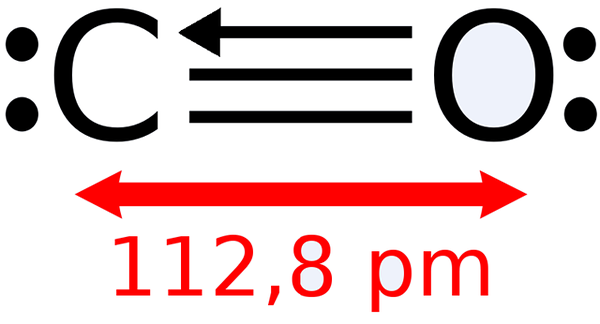 Lewis Struktura tlenku węgla
Lewis Struktura tlenku węgla -Dwutlenek węgla, CO2 (gaz, który tworzy nasze wydech)
-Amoniak, NH3 (istotna substancja dla procesów przemysłowych symfiny)
-Trójtlenek siarki, więc3
-Metan, rozdz4 (gaz domowy, z którym jest gotowany)
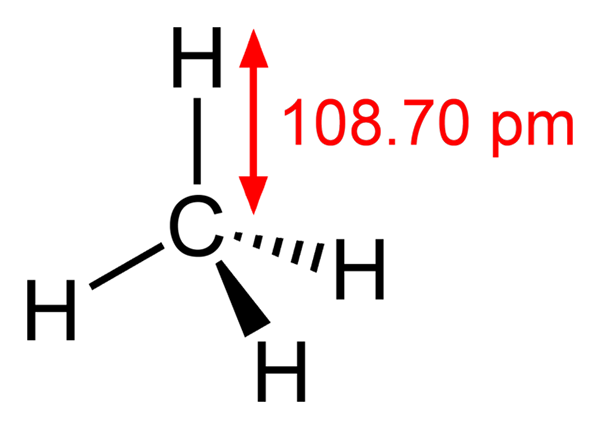 Struktura metanu
Struktura metanu -Etano, rozdz3Ch3
-Dwutlenek azotu, nie2 (Brązowy kolor zabarwienia)
-Phosgen, Cocl2 (wysoce trująca substancja)
-Powietrze (będąc mieszaniną azotu, tlenu, argonu i innych gazów)
-Pary wodne, h2Lub (który jest częścią chmur, geiserów, waporyzatorów maszyn itp.).
-Acetylen, HC≡CH
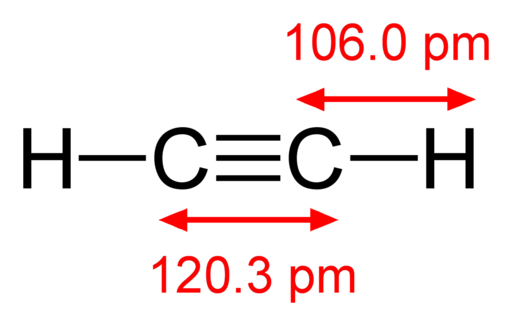 Strukturalna formuła acetylenu
Strukturalna formuła acetylenu -Pary jodu, i2 (Purple Kolor Gas)
-Hexafluoruro siarki, sf6 (bardzo gęsty i ciężki gaz)
-Hydrazine, n2H4
-Chlorek wodoru, HCL (który rozpuszczony w wodzie wytwarza kwas solny)
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2020). Gaz. Źródło: w:.Wikipedia.org
- Edward a. Mason. (6 lutego 2020). Gaz. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Helmestine, Anne Marie, pH.D. (11 lutego 2020). Definicja gazu i przykład w chemii. Odzyskane z: Thoughtco.com
- María Estela Raffino. (12 lutego 2020). Jaki jest stan gazowy? Odzyskane z: koncepcja.z

