Erytroblasty Czym są erytropoiesis, powiązane patologie
- 3178
- 901
- Herbert Wróblewski
erytroblasty Są to komórki prekursorowe erytrocytów kręgowców. Zmniejszenie stężenia tlenu w tkankach będzie promować zdarzenia różnicowania komórek w tych komórkach, które spowodują dojrzałe erytrocyty. Zestaw wszystkich tych wydarzeń jest znany jako erytropoiesis.
Podczas erytropoezy wzrasta synteza hemoglobiny. Obfite białko w erytrocytach, które pośredniczy w dostawie tlenu do tkanek i detoksykacji ich dwutlenku węgla, produktu oddechu toksycznego komórek na komórkach dla komórek komórek.
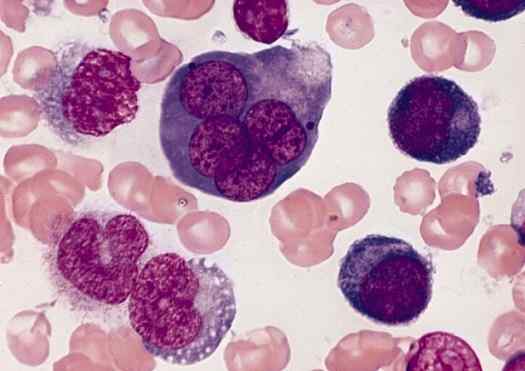
 Rozmaz z erytroblastem, komórki prekursorowe dojrzałych erytrocytów. Przez Siły Zbrojne Instytut Patologii (AFIP) [domena publiczna (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons.Całkowita utrata jądra, a także organelli komórkowych, oznacza kulminację procesu erytropoezy w komórkach kręgowców ssakowych. W pozostałej części kręgowców, takich jak gady, jądro utrzymuje się po zakończeniu procesu różnicowania.
Rozmaz z erytroblastem, komórki prekursorowe dojrzałych erytrocytów. Przez Siły Zbrojne Instytut Patologii (AFIP) [domena publiczna (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons.Całkowita utrata jądra, a także organelli komórkowych, oznacza kulminację procesu erytropoezy w komórkach kręgowców ssakowych. W pozostałej części kręgowców, takich jak gady, jądro utrzymuje się po zakończeniu procesu różnicowania.
Błędy w procesie różnicowania erytroblastów powodują zestaw patologii krwi, które jako całość nazywane są anemie megaloblastyczne.
[TOC]
Co to są erytrocyty?
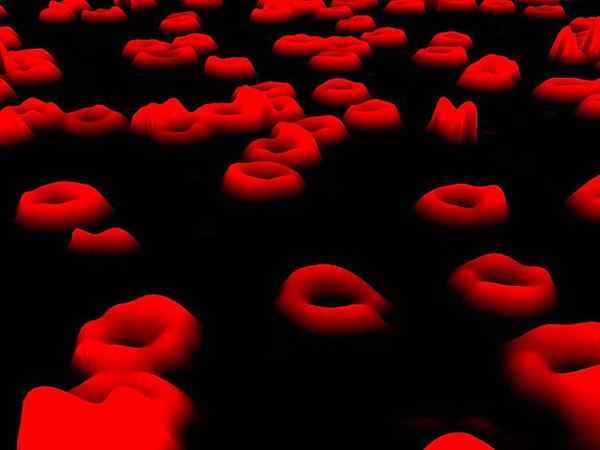 Obraz erytrocytów uzyskanych za pomocą mikroskopii holograficznej. Autor: Egelberg [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons.Erytrocyty, powszechnie znane jako czerwone krwinki, są najliczniejszymi komórkami we krwi kręgowców.
Obraz erytrocytów uzyskanych za pomocą mikroskopii holograficznej. Autor: Egelberg [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons.Erytrocyty, powszechnie znane jako czerwone krwinki, są najliczniejszymi komórkami we krwi kręgowców.
Mają charakterystyczną morfologię podobną do dysków Bicócavos, a ich główną funkcją jest przeprowadzenie transportu tlenu (O2) do różnych tkanek organizmu, jednocześnie detoksykacji ich dwutlenku węgla (CO2) wytwarzanego podczas ciężkiego oddychania komórkowego.
Ta wymiana CO2 przez O2 jest możliwa, ponieważ komórki te mają duże ilości charakterystycznego białka czerwonego zwanego hemoglobiną, zdolne do interakcji z obiema gatunkami chemicznymi poprzez grupę HEM obecną w jej strukturze.
Osobliwość tych komórek u ssaków w odniesieniu do reszty kręgowców jest brak organelli rdzeniowych i cytoplazmatycznych. Jednak na początkowych fazach produkcji we wczesnych stadiach rozwoju embrionalnego zaobserwowano, że prekursory komórek, z których pochodzą.
Te ostatnie nie są dziwne, ponieważ pierwsze fazy rozwoju zarodka są zwykle podobne u wszystkich kręgowców, rozmieszczając tylko etapy, które zagrażają większym zróżnicowaniu.
Może ci służyć: płyn śródmiąższowy: skład i funkcjeCzym są erytroblasty?
Erytroblasty to komórki, które spowodują dojrzałe erytrocyty po doświadczeniu kolejnych zdarzeń różnicowania komórek.
Te komórki prekursorowe pochodzą ze wspólnego rodzica szpikowego w szpiku kostnym kręgowców, takich jak komórki zarodkowe, wyposażone w organelle rdzeniowe i komórkowe.
Zmiany zawartości jej cytoplazmy i ponownego przeciągania cytoszkieletu będą zwieńczyć w wytwarzaniu erytrocytów gotowych do wprowadzenia krążenia. Zmiany te reagują na bodźce środowiskowe wskazujące na spadek tlenu w tkankach, a zatem na zapotrzebowanie na wytwarzanie erytrocytów.
Co to jest erytropoiesis?
Erytropoiesis to termin używany do zdefiniowania procesu, w którym odbywa się produkcja i rozwój czerwonych krwinek, niezbędny do utrzymania dostaw tlenu do różnych narządów i tkanek.
Proces ten jest drobno regulowany przez działanie erytropoetyny (EPO), hormonu syntezy nerek, który z kolei jest modulowany przez stężenia tlenu dostępne w tkankach.
Niskie stężenia tlenu tkanki indukują syntezę EPO przez czynnik transkrypcyjny indukowany niedotlenieniem (HIF-1), który stymuluje proliferację erytrocytów za pomocą środków.
U ssaków erytropoiesis odbywa się na dwóch etapach, które noszą nazwę prymitywnej erytropoezji i ostatecznej erytropoezy.
Pierwszy występuje w worku Vitelino podczas rozwoju embrionalnego, co daje duże zarodkowane erytroblasty, podczas gdy drugi ma miejsce w wątrobie płodowej i trwa w szpiku kostnym po drugim miesiącu ciążowego generującego mniejsze erytrocyty erytrocyty.
Inne białka, takie jak cytocyna antypoputyczna BCL-X, której transkrypcja jest regulowana przez czynnik transkrypcyjny GATA-1, również pozytywnie wpływają. Ponadto konieczne są również zaopatrzenie w żelazo, witamina B12 i kwas foliowy.
Może ci służyć: nukleoplasmaRóżnicowanie erytroblastów w erytrocytach
W definitywnym procesie erytropoezyjnym erytrocyty powstają w szpiku kostnym z niezróżnicowanej komórki progenitorowej lub wspólnego rodzica szpiku, zdolnego do wywołania innych komórek, takich jak granulocyty, monocyty i płytki krwi.
Ta komórka powinna otrzymać odpowiednie sygnały pozakomórkowe, aby zagrozić jej różnicowaniu do linii erytroidalnej.
Po nabyciu tego zobowiązania rozpoczyna się sekwencja zdarzeń różnicowania, która rozpoczyna się od tworzenia się pronormoblastu, znanego również jako proeritroblast. Komórka prekursorowa erytroblastów, duże i jądra.
Następnie proeritroblast doświadczy postępującego spadku objętości komórek jądrowych, któremu towarzyszy wzrost syntezy hemoglobiny. Wszystkie te zmiany występują powoli, gdy komórka ta przechodzi różne stadia komórkowe: erytroblast lub normoblast bazofilo, polichromatyczny erytroblast i ortochromatyczny erytroblast.
Proces kończy się całkowitą utratą jądra, a także organelli obecnych w ortochromatycznym erytroblastie powodującym dojrzały erytrocyt.
Aby wreszcie się do tego dojść, ten ostatni musi przejść przez stadion retikulocytów, komórkę enuklowaną, która nadal zawiera w organellach i cytoplazmie rybosomów. Całkowita eliminacja jądra i organelli odbywa się przez egzocytozę.
Dojrzałe erytrocyty pozostawiają szpik kostny do krwioobiegu, gdzie pozostają około 120 dni, zanim zostaną pochłonięte przez makrofagi. Dlatego erytropoiesis jest procesem, który występuje w sposób ciągły przez całe życie organizmu.
Różnicowanie komórek
W miarę jak erytoblasty zmierzają w kierunku całkowitego różnicowania w dojrzałym erytrocycie, doświadczają wielu zmian w cytoszkielecie, a także w ekspresji komórkowych białek adhezyjnych.
Mikrofilamenty aktyny są depolimeryzowane i składa się nowy cytoszkielet oparty na spektrynie. Spektryna jest obwodowym białkiem błony znajdującym się na powierzchni cytoplazmatycznej, które oddziałuje z ankiliną, białkiem, które pośredniczy w połączeniu cytoszkieletu z pasmem transmarketowym białkiem 3.
Te zmiany w cytoszkielecie i ekspresja receptorów dla EPO, a także mechanizmów, które je modulują, mają kluczowe znaczenie dla dojrzewania erytroidu.
Może ci służyć: fibroblastyWynika to z faktu, że ustanowienie interakcji między erytroblastami i komórkami obecnymi w mikrośrodowisku szpiku kostnego.
Po zakończeniu różnicowania wystąpią nowe zmiany, które sprzyjają utraty przyczepności komórek sznurkowych i ich uwalnianie do potoku krwi, gdzie wypełnią swoją funkcję.
Patologie związane z błędami w różnicowaniu erytroblastów
Błędy podczas różnicowania erytroblastów w szpiku kostnym powodują pojawienie się patologii krwi, takich jak anemie megaloblastyczne. Mają one swoje pochodzenie z niedoborów dostaw witaminy B12 i folianów niezbędnych do promowania różnicowania erytroblastów.
Termin megaloblastyczny odnosi się do dużej wielkości, jaką erytroblasty, a nawet erytrocyty osiągają jako produkt nieskutecznej erytropoezy, charakteryzujący się wadliwą syntezą DNA.
Bibliografia
- Ferreira R, Ohneda K, Yamamoto M, Philipsen S. Funkcja GATA1, paradygmat czynników transkrypcyjnych w hematopoiesis. Biologia molekularna i komórkowa. 2005; 25 (4): 1215-1227.
- Kingsley PD, Malik J, Fantauzo KA, Palis J. Pierwotne erytrroblasty pochodzące z żółtka enuklasty podczas ergyogenezy ssaków. Blood (2004); 104 (1): 19-25.
- Konstantinidis DG, Pushkaran S, Johnson JF, Anulus JA, Manganaris S, Harris CE, Williams AE, Zheng i Kalfa TA. Wymagania sygnalizacyjne i cytoszkieletowe w erytroblastu. Krew. (2012); 119 (25): 6118-6127.
- Migliaccio AR. Erytroblastowy enukleacja. Haematologica. 2010; 95: 1985-1988.
- Shivani Soni, Shashi Bala, Babette Gwynn, Kenneth E, Luanne L, Manjit Hanspal. Brak białka makrofagów erytroblastowych (EMP) prowadzi do niepowodzenia erytroblastowego nuklearnego. The Journal of Biological Chemistry. 2006; 281 (29): 20181-20189.
- Skutelsky E, Danon D. Mikroskopowe badanie eliminacji jądrowej z późnego erytroblastu. J Cell Biol. 1967; 33 (3): 625-635.
- Tordjman R, Delaire S, Plouet J, Ting S, Gaulard P, Ficelson S, Romeo P, Lemarchandel V. Erytroblaty są źródłem czynnika angiogennego. Blood (2001); 97 (7): 1968-1974.
- « Botanika kryptogamiczna, jakie badania, koncepcje
- Wspólne cechy tijereta, siedlisko, reprodukcja, odżywianie »

