Równowaga ciecz-vapor

- 2250
- 106
- Bertrand Zawadzki
Co to jest równowaga ciecz?
On Równowaga ciecz-vapor Jest to stan dynamiczny, który ustanawia ciecz, czy to czysta substancja, czy mieszanka, z parą otaczającą i oddziaływaną z jej powierzchnią. Aby mieć miejsce, pojemnik musi zostać zamknięty, w przeciwnym razie prądy powietrza spowodowałyby powoli odparowywać ciecz.
Po zamknięciu systemu ciśnienie wywierane przez cząsteczki fazy pary będzie się wspinać w miarę upływu czasu. Przyjdzie punkt, w którym presja się zatrzyma; Jest to ciśnienie pary cieczy, która jest właściwością fizyczną materii, niezależną od wielkości pojemnika lub objętość cieczy.
 Po odkrywaniu napoju gazowego jego równowaga płynów wapki jest zaburzona, powodując nierównowagę ciśnień na zewnątrz i wewnątrz butelki, a wraz z nią bubb. Źródło: OpenStax, CC przez 4.0, Via Wikimedia Commons
Po odkrywaniu napoju gazowego jego równowaga płynów wapki jest zaburzona, powodując nierównowagę ciśnień na zewnątrz i wewnątrz butelki, a wraz z nią bubb. Źródło: OpenStax, CC przez 4.0, Via Wikimedia Commons Każda ciecz, czysty lub mieszany, będzie miał powiązane ciśnienie pary, które będzie zależeć od zmienności jej składników; I dlatego siły międzycząsteczkowe, które utrzymują je razem w cieczy i na ich powierzchni.
Presję tę można opisać, zakładając idealność roztworów lub mieszalność składników mieszanki. Aby to zrobić, zastosowanie schematów binarnych jest bardzo przydatne, w których możliwe jest rozważenie żywotności procesu separacji.
Równowaga ciekłokwiowo-pręta jest niezbędna do nieskończoności procesów inżynierii chemicznej, takich jak frakcjonalne destylacje i te wykonane z pary wodnej, przez które uzyskuje się destylowane destylowane w najbardziej lotnych komponentach. Tak jest w przypadku etanolu w wieku 95.4% w wodzie, będąc najbardziej dostępnym i ekonomicznym procentem alkoholu na rynku.
Czyste substancje
Cząsteczki czystej substancji nie są nieruchome, ale przenoszą się z jednego miejsca do drugiego dzięki wewnętrznej energii kinetycznej. Ta energia może czasem być wystarczająco duża, aby przezwyciężyć siły międzycząsteczkowe, które „ciągną” cząsteczkę z konkretnej do piersi płynnej. Następnie cząsteczka ucieknie z powierzchni cieczy do fazy pary.
W fazie pary cząsteczki będą zderzały się z wewnętrznymi ścianami pojemnika, wygrywając lub tracąc prędkość, aż ponownie połączą się z powierzchnią cieczy, gdzie po zintegrowaniu konglomeratu cząsteczek fazy ciekłej fazy ciekłej.
Może ci służyć: Cobalt: Struktura, właściwości, aplikacjeZatem czas trwa aż do pewnej temperatury (powiedzieć 25 ° C), liczba cząsteczek, które uciekają na powierzchni, równa się tych, które wchodzą z pary. Mówi się zatem, że w czystej substancji ustalono równowagę ciekłej.
Ciśnienie pary, aby doświadczyć wewnętrznych ścian pojemnika, a także powierzchni cieczy, będzie równe PDOº, który jest stały i powtarzalny; Niezależnie od tego, jak duży lub mały jest pojemnik, ani objętość cieczy do rozważenia.
Mieszanki
W mieszaninach cieczy pojawi się również komponent, który wywiera ciśnienie na powierzchni cieczy i konturach pojemnika. Twoje ciśnienie pary, jak można się spodziewać, składa się z wkładu każdego ze składników mieszaniny, mówiąc, dwie substancje a i b. Te mieszanki mogą być mieszalne, częściowo mieszalne.
Mieszalne
W mieszanej mieszaninie między A i B obie substancje tworzą jedną fazę, która na pierwszy rzut oka wygląda jak czysta substancja. Zatem, zgodnie z prawem Daltona, ciśnienie mieszaniny lub roztworu będzie równe:
Psłońce = PDO + PB +··· PSiema
Bycie pSiema Każdy inny składnik, który jest również obecny w mieszance. Zwróć uwagę, że pDO≠ strDOº, to znaczy ciśnienie substancji w mieszaninie nie są takie same jak w przypadku ich stanów o wysokiej czystości.
Przy założeniu, że rozwiązanie jest idealne, różnice między interakcjami A-A, B-B i A-B są oczywiste. Można to zastosować na przykład w mieszaninie etanolu i metanolu.
Dlatego ciśnienie pary komponentów w mieszaninie będzie zależeć od ich względnych ilości w fazie ciekłej, wyrażanych jako frakcje molowe xSiema. I tutaj jest interweniowanie prawa Raaulta, które ma na celu powiązanie presji pDO I pDOº:
PDO = XDO PDOº
Będąc teraz całkowite ciśnienie równe:
Psłońce = XDO PDOº + xB PBº +···
Z drugiej strony faza parowa będzie miała własne kompozycje, wyrażone jako frakcje molowe Yi:
Yi = pSiema / Psłońce
= XSiema PSiemaº / psłońce
Schemat binarny
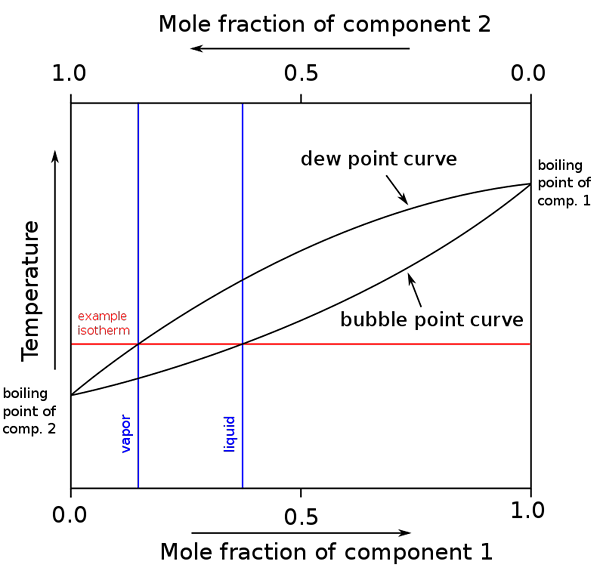 Schemat punktów wrzenia i składu trzonowego dla mieszaniny binarnej. Źródło: Binary_boiling_point_diagram.PNG: H Padleckasderivative Prace: Michbich, CC BY-SA 2.5, Via Wikimedia Commons
Schemat punktów wrzenia i składu trzonowego dla mieszaniny binarnej. Źródło: Binary_boiling_point_diagram.PNG: H Padleckasderivative Prace: Michbich, CC BY-SA 2.5, Via Wikimedia Commons Gdy frakcje molowe składników mieszaniny binarnej (A + B) są graficzne, w zależności od temperatury lub ciśnienia uzyskuje się schematy binarne (patrz wyżej). Ta konkretna forma, najprostsza, odpowiada idealnym rozwiązaniom.
Może ci służyć: objętość molowa: koncepcja i wzór, obliczenia i przykładyObszar powyżej „owalny” odpowiada fazie pary, podczas gdy obszar poniżej odpowiada fazie ciekłej mieszaniny. Zauważ, że gdy frakcja molowa składnika 1 lub wynosi 0 (x1= 0), frakcja molowa składnika 2 lub B będzie równa 1 (x2= 1), a następnie ciśnienie pary zawdzięcza tylko B. Ta temperatura staje się temperaturą wrzenia B.
Tymczasem na drugim końcu (po prawej), gdy x2= 0, ale x1= 1, ciśnienie pary jest tylko. Ta temperatura staje się temperaturą jego temperatury wrzenia.
Dolna owalna linia odpowiada punkcie pęcherzyka, czyli wtedy, gdy pierwsza pęcherz pojawia się, gdy ciekła mieszanina jest podgrzewana (w górę schematu). A górna linia odpowiada punkcie rosy, czyli wtedy, gdy faza parowa ostygnie i pojawia się pierwszy kropla (zejście na schemacie).
Azeotropos
W wielu roztworach niedealnych będziemy mieć azeotropy, które są mieszaninami, które odparowują utrzymanie ich składu; to znaczy odparowują tak, jakby były czystym związkiem.
Niemożliwe jest „złamanie” kompozycji azeotropowej poprzez bardziej kroki destylacji. Zamiast tego do zwiększenia czystości pożądanego komponentu stosuje się inne metody.
Na przykład mieszanka etanolu-woda tworzy azeotropowy z kompozycją 95.4 etanolu. Oznacza to, że niemożliwe jest uzyskanie etanolu o stężeniu większym niż 95 jest niemożliwe.4%; Zawsze będzie 4.6% pozostałej wody. Jeśli chciałbyś przygotować bezwzględny etanol (100%), konieczne byłoby użycie materiałów odwodniowych lub innych tras syntezy.
Na schemacie binarnym możemy zobaczyć obecność azeotropu, który przedstawia następującą formę:
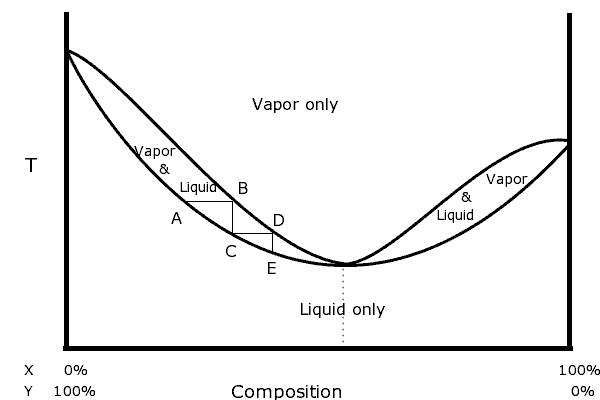 Schemat binarny mieszaniny z dodatnim azeotropowym. Źródło: Karlhahn w angielskiej Wikipedii, domena publiczna, przez Wikimedia Common
Schemat binarny mieszaniny z dodatnim azeotropowym. Źródło: Karlhahn w angielskiej Wikipedii, domena publiczna, przez Wikimedia Common Po lewej stronie diagramu można zauważyć, że w ramach „owalnego”, regionu, w którym mamy równowagę ciekłokopowlową, możemy destylować w kolejnych etapach (a, b, c, d i e), aby uzyskać coraz bogatą bogatą mieszanina w najbardziej lotnym komponencie (x dla tego schematu).
Jednak w punkcie azeotropowym mieszanka X i Y i gotowania, tak jakby była pojedynczą substancją, więc nie ma znaczenia, ile destylacji jest wykonanych, zarówno ciecz, jak i para będą miały ten sam skład.
Może ci służyć: wzór molekularny: jak to wyciągnąć, przykłady i ćwiczeniaCzęściowo mieszalne
W częściowo mieszaninach będą one utworzone, w zależności od temperatury, dwóch rozpoznawalnych faz: jedna bogata w składnik A i drugi bogaty w komponent B. Schematy binarne dla tych przypadków są o wiele bardziej rygorystyczne i szerokie, ponieważ obejmują one regiony, w których para współistnieje wraz z dwiema fazami.
Niedomyślne
Mówiąc o niemożliwych mieszaninach, każdy komponent będzie zachowywał się tak, jakby był w stanie wysokiej czystości, ponieważ ledwo oddziałuje z innymi cząsteczkami. Dlatego ciśnienie pary dla tych mieszanin będzie równe:
Psłońce = PDOº + pBº +··· PSiemaº
Mieszanina będzie gotować w temperaturze niższej niż w przypadku czystych komponentów, ponieważ ciśnienie niemieszalnej mieszaniny będzie wyższe, ponieważ jest równa suma ciśnienia każdego składnika w jego czystym stanie. Większe ciśnienie pary implikuje, że jest ono bardziej lotne, dlatego gotuje się w niższej temperaturze.
Aplikacje
Destylacje
W destylacjach, szczególnie na poziomie przemysłowym, wiedza na temat równowagi płynno-wolmarskiej jest pierwotna. Na podstawie składników mieszaniny i jej diagramów fazowych można obliczyć, ile potraw jest potrzebnych w budowie wieży frakcjonowej w celu prawidłowego oddzielenia wspomnianych komponentów.
Destylacja pary wodnej
Pary wodne można pompować wewnątrz mieszanki pod destylacją. Podczas bulgotania pary wody w cieczy zostanie zwiększone ciśnienie pary mieszaniny, więc gotuje się w niższej temperaturze i pomoże wydobyć najbardziej lotne elementy (takie jak esencje).
Picie ptaka
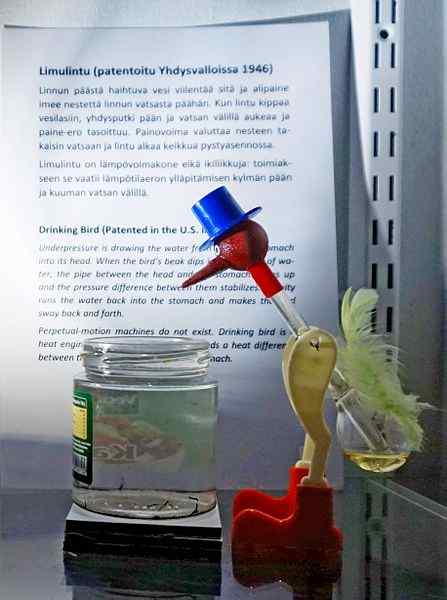 Picie ptak, jedna z najbardziej genialnych zabawek wszechczasów. Źródło: Tiia Monto, CC BY-SA 4.0, Via Wikimedia Commons
Picie ptak, jedna z najbardziej genialnych zabawek wszechczasów. Źródło: Tiia Monto, CC BY-SA 4.0, Via Wikimedia Commons Chociaż nie jest to dokładnie równowaga płynna wapki, prawda jest taka, że za działaniem ptaka do picia kilka zjawisk termodynamicznych jest ukrytych.
Kiedy głowa ptaka jest mokra, zaczyna ostygnąć, gdy woda odparowuje. Ten spadek temperatury powoduje spadek ciśnienia wewnątrz głowy ptaka. Chlorek metylenowy, znajdujący się u podstawy ptaka, będzie starał się zrównoważyć ciśnienia, przepływając przez szklaną rurkę, która łączy głowę z głową.
Płyn wzniesie się do głowy ptaka, czyniąc go cięższym i przechyla się do przodu. Następnie ptak „pić wodę”, a ciśnienie parowe równoważą. Zrównoważyć ciśnienie, ptak ptaka powróci do pozycji pionowej, a cykl zostanie powtórzony, podczas gdy woda głowy ponownie wyparuje.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Walter J. Moore. (1962). Chemia fizyczna. (Czwarta edycja). Longmans.
- Wikipedia. (2020). Równowaga pary i ciecz. Źródło: w:.Wikipedia.org
- Ed Vitz i in. (5 listopada 2020). Równowaga pary i ciecz. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Limer Eric. (30 stycznia 2018 r.). Absurdalnie szczegółowe wyjaśnienie picia zabawki ptaków. Odzyskane od: popularnamechanika.com
- University of Alicante. (S.F.). Temat 4: Obliczanie bilansu. Schematy równowagi. [PDF]. Odzyskane z: rua.Ua.Jest

