Polarne kowalencyjne charakterystyka i przykłady
- 3923
- 633
- Bertrand Zawadzki
A Polarne kowalencyjne wiązanie To utworzone między dwoma elementami chemicznymi, których różnica elektroungatywności jest znaczna, ale bez zbliżania się do czysto jonowego. Jest to zatem pośrednia silna interakcja między niepolarnymi wiązaniami kowalencyjnymi i linkami jonowymi.
Mówi się, że jest to kowalencyjne, ponieważ teoretycznie istnieje sprawiedliwe dzielenie się pary elektronicznej między dwoma powiązanymi atomami; to znaczy, dwa elektrony są dzielone jednakowo. Atom E · przekazuje elektron, podczas gdy · x zapewnia drugi elektron w celu utworzenia wiązania kowalencyjnego E: X lub E-X.
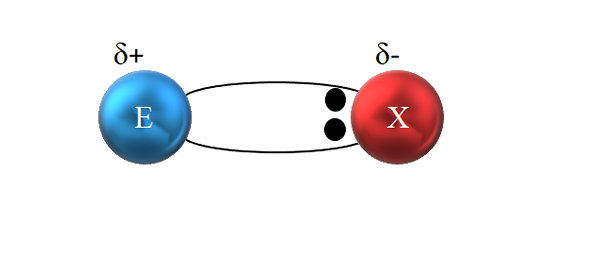
 W polarnym kowalencyjnym wiązaniu para elektronów nie jest wspólna wspólna. Źródło: Gabriel Bolívar.
W polarnym kowalencyjnym wiązaniu para elektronów nie jest wspólna wspólna. Źródło: Gabriel Bolívar. Jednak, jak widać na obrazie wyższym, dwa elektrony nie znajdują się w środku E i X, co wskazuje, że „krąży” o tej samej częstotliwości między obiema atomami; ale są bliżej x niż e. Oznacza to, że X przyciągnął do siebie parę elektronów ze względu.
Będąc elektronami łącza bliżej x niż e, około x powstaje obszar o wysokiej gęstości elektronicznej, δ-; Podczas gdy w Ebe regionie pojawia się w elektronach, δ+. Dlatego istnieje polaryzacja ładunków elektrycznych: polarna kowalencyjna wiązanie.
[TOC]
Charakterystyka
Stopnie polaryzacji
Kowalencyjne więzi mają bardzo obfity charakter. Są one praktycznie obecne we wszystkich heterogenicznych cząsteczkach i związkach chemicznych; ponieważ w końcu powstaje, gdy dwa różne atomy E i X są połączone. Istnieje jednak więcej polarnych wiązań kowalencyjnych niż inne i aby dowiedzieć się, że musisz uciekać.
O ile bardziej elektroongenacyjna jest x, a mniej elektroongeneracyjna (elektropozytywna), wówczas powstałe wiązanie kowalencyjne będzie bardziej polarne. Tryb konwencjonalny do oszacowania tej polaryzacji jest wzór:
Może ci służyć: borobilowodorek sodu (NABH4): struktura, właściwości, zastosowaniaχX - χI
Gdzie χ jest elektroonywentnością każdego atomu zgodnie ze skalą Paulinga.
Jeśli ta odejmowanie lub odejmowanie ma wartości między 0,5 a 2, będzie to łącze polarne. Dlatego możliwe jest porównanie stopnia polaryzacji między kilkoma linkami E-X. W przypadku, gdy uzyskana wartość jest wyższa niż 2, mówi się o linku jonowym i+X- I to nie jestδ+-Xδ-.
Jednak biegunowość łącza E-X nie jest absolutna, ale zależy od środowisk molekularnych; To znaczy w cząsteczce -E-x-, gdzie e i x tworzą kowalencyjne wiązania z innymi atomami, te ostatnie bezpośrednio wpływają na ten stopień polaryzacji.
Elementy chemiczne, które je pochodzą
Podczas gdy E i X mogą być dowolnym elementem, nie wszystkie polarne wiązania kowalencyjne. Na przykład, jeśli E jest wysoce elektropozytywnym metalem, takim jak alkaliczna (Li, Na, K, Rb i CS) i X A halogen (F, Cl, Br i I), będą one tworzyć związki jonowe (Na (Na+Cl-), a nie cząsteczki (Na-Cl).
Właśnie dlatego polarne wiązania kowalencyjne są zwykle między dwoma elementami niemetalicznymi; oraz w mniejszym stopniu, między elementami niemetalicznymi a niektórymi metaliami przejściowymi. Widząc blok P Z okresowych tabeli istnieje wiele opcji tworzenia tego rodzaju linków chemicznych.
Charakter polarny i jonowy
W dużych cząsteczkach nie jest ważne, aby zastanowić się, jak link jest polarny; Są one wysoce kowalencyjne, a rozmieszczenie ich ładunków elektrycznych (gdzie są bogate lub biedne regiony elektronów) jest większą uwagą na zdefiniowanie stopnia kowalenowości ich wewnętrznych powiązań.
Może ci służyć: chromatografia gazowaJednak w przypadku dwuatomicznych lub małych cząsteczek, powiedziała polarność iδ+-Xδ- Jest dość względny.
Nie stanowi to problemu z cząsteczkami utworzonymi między elementami niemetalicznymi; Ale gdy uczestniczą metali przejściowe lub metaloidalne, nie ma już tylko mówienia o polarnej kowalencyjnej wiązaniu, ale kowalencyjnym wiązaniu z pewnym charakterem jonowym; aw przypadku metali przejściowych, kowalencyjnego łącza koordynacyjnego, biorąc pod uwagę charakter tego samego.
Przykłady wiązania polarnych
WSPÓŁ
Kowalencyjne wiązanie między węglem a tlenem jest polarne, ponieważ pierwszy jest mniej elektroony (χC = 2,55), że drugi (χALBO = 3,44). Dlatego, gdy widzimy linki C-O, C = O o C-O-, Będziemy wiedzieć, że są to linki polarne.
H-X
Halogendy wodoru, HX, są idealnymi przykładami do zrozumienia wiązania polarnego w ich cząsteczkach dwuatomicznych. O elektroonywatywności wodoru (χH = 2.2), możemy oszacować, jak te polarne są halogenomory:
-HF (H-F), χF (3.98) - χH (2,2) = 1,78
-HCl (H-Cl), χCl (3,16) - χH (2,2) = 0,96
-HBR (H-BR), χBr (2.96) - χH (2,2) = 0,76
-Cześć (H-i), χSiema (2.66) - χH (2,2) = 0,46
Zauważ, że zgodnie z tymi obliczeniami łącze H-F jest najbardziej polarne ze wszystkich. Teraz, jaki jest jego charakter jonowy wyrażony jako procent, to kolejny temat. Ten wynik nie jest zaskakujący, ponieważ fluor jest najbardziej elektroonegatywnym elementem wszystkich.
Kiedy elektrocjalność opada z chloru do jodu, łącza H-CL, H-BR i H-I stają się mniej polarne. Łącze H-I powinno być apoliste, ale w rzeczywistości jest polarne, a także bardzo „kruche”; Łatwo pęka.
Może ci służyć: wodorotlenek rtęci: struktura, właściwości, zastosowania, ryzykoOH
Polarne link o-H może być najważniejsze: dzięki niemu jest życie, ponieważ współpracuje z dipolowym momentem wody. Jeśli oszacujemy różnicę między elektroonegativities tlenu i hydrogenów, będziemy mieli:
χALBO (3.44) - χH (2,2) = 1,24
Jednak cząsteczka wody, h2Lub ma dwa z tych linków, h-O-h. To i geometria kątowa cząsteczki i jej asymetrii sprawiają, że jest to wysoce polarny związek.
N-h
Link N-H jest obecny w grupach aminowych białek. Powtarzając te same obliczenia, które mamy:
χN (3.04) - χH (2,2) = 0,84
Odzwierciedla to, że łącze N-H jest mniej polarne niż O-H (1,24) i F-H (1,78).
Brzydki
Link Fe-O jest ważny, ponieważ ich tlenki znajdują się w żelaznych minerałach. Zobaczmy, czy jest bardziej polarny niż H-O:
χALBO (3.44) - χWiara (1,83) = 1,61
Stąd słusznie przypuszcza się, że link FE-O jest bardziej polarny niż link H-O (1,24); Albo co to samo, co powiedzenie: Fe-O ma większy charakter jonowy niż H-O.
Obliczenia te służą do wykrywania stopni polaryzacji między kilkoma linkami; Ale nie są wystarczające, aby rządzić, czy związek jest jonowy, kowalencyjny, czy jego charakter jonowy.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Laura Nappi. (2019). Polarne i niepolarne wiązania kowalencyjne: definicje i przykład. Badanie. Odzyskane z: Study.com
- Helmestine, Anne Marie, pH.D. (18 września 2019). Definicja wiązania polarnego i przykład (wiązanie polarne). Odzyskane z: Thoughtco.com
- Elsevier b.V.(2019). Polarne kowalencyjne wiązanie. Scientedirect. Pobrano z: Scientedirect.com
- Wikipedia. (2019). Polaryzacja chemiczna. Źródło: w:.Wikipedia.org
- Anonimowy. (5 czerwca 2019). Właściwości polarnych wiązań kowalencyjnych. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- « Origine, Charakterystyka, części, funkcje, typy, typy
- 80 powodów, dla których cię kocham lub kocham »

