Niepolarne wiązanie kowalencyjne
- 4773
- 998
- Paweł Malinowski
Wyjaśniamy, czym jest niebłędne kowalencyjne wiązanie, jej cechy i kilka przykładów
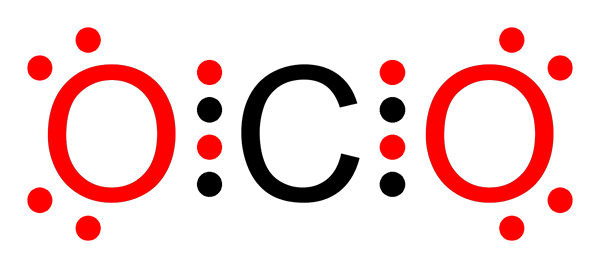
 Niepolarne kowalencyjne wiązanie dwutlenku węgla
Niepolarne kowalencyjne wiązanie dwutlenku węgla Co to jest nietopolarne wiązanie kowalencyjne?
A Niepolarne wiązanie kowalencyjne, Nazywany również czystym lub apolowym wiązaniem kowalencyjnym, jest to połączenie dwóch atomów, które dzielą jedną lub więcej par elektronów w równym stopniu. Innymi słowy.
Ten typ łącza jest między dwoma równymi atomami (tego samego elementu) lub między dwoma różnymi atomami, ale które mają bardzo podobne elektroonegatyczność.
Istnieją trzy rodzaje linków chemicznych, które utrzymują atomy razem. Są to: wiązanie jonowe, wiązanie kowalencyjne i metalowy łącznik. Te linki różnią się w zależności od tego, jak rozkłada się elektronów wokół atomów.
W przypadku wiązań kowalencyjnych dwa atomy dzielą elektrony walencyjne, co oznacza, że elektrony te, zamiast obracać się wokół atomu, obracają się wokół dwóch. Jednak nie zawsze jest to sprawiedliwe, ponieważ elektrony wolą spędzać więcej czasu w pobliżu najbardziej elektrowni, co daje polarne wiązanie kowalencyjne.
W przypadku niezarodowych wiązań kowalencyjnych to się nie zdarza, ponieważ oba atomy mają taką samą elektrocjalność lub bardzo podobne elektro.
Charakterystyka niezolarnego łącza kowalencyjnego
1. Powstają między atomami o równych lub bardzo podobnych elektroungelicznościach
Są to kowalencyjne łącza, które tworzą się między równymi atomami lub mają bardzo podobne elektroonegatywność. Zasadniczo wiązanie kowalencyjne jest uważane za nie polarne, jeżeli różnica elektroungatiwowości jest mniejsza lub równa 0,4.
Może ci służyć: kwas bursztynowy: struktura, właściwości, uzyskiwanie, zastosowania2. Mogą być proste, podwójne lub potrójne
W zależności od liczby par elektronów, które oba atomy dzielą, nieziarne lub apolowe wiązania kowalencyjne mogą być proste, podwójne lub potrójne.
Gdy wiązanie jest tworzone przez pojedynczą parę elektronów, nazywa się to prostym ogniwem, gdy udostępniane są dwie pary elektronów, nazywa się to podwójnym wiązaniem, a jeśli udostępniane są trzy pary elektronów, nazywa się Triple Link.
3. Prawie zawsze obejmują nieMetale
Metale są elementami o bardzo niskich elektrowni, które tworzą ze sobą metalowe łącza. Po powiązaniu z nie -metalami zawsze tworzą wiązania jonowe lub łącza polarne. Z tego powodu nie -spolarne wiązania kowalencyjne powstają wyłącznie między elementami niemetalicznymi, takimi jak wodór i węgiel.
4. Powodują powstanie związków apolarnych
Związek, który ma tylko nietopolarne wiązania kowalencyjne, powstanie przez cząsteczki apolarne. Tego rodzaju związki charakteryzują się niskim punktem wrzenia i fuzji w porównaniu z metaliami i związkami jonowymi (niektóre są nawet gazy w temperaturze pokojowej), są nierozpuszczalne w wodzie i są złymi przewodami ciepła i energii elektrycznej.
5. Mogą tworzyć stałe, ciekłe lub gazowe związki w temperaturze pokojowej
Związki z niezarodowymi wiązaniami kowalencyjnymi mogą mieć niskie, ale bardzo zróżnicowane punkty wrzenia i fuzji.
Z tego powodu niektóre z nich to gazy w temperaturze pokojowej (takie jak wodór, H2, i azot, n2), inne to płyny (takie jak Bromo, BR2), podczas gdy inne są solidne (takie jak naftalen, c10H8).
6. Mają stosunkowo niskie energie linków.
W porównaniu z linkami jonowymi, nietrowymi kowalencyjnymi wiązaniami są łatwiejsze do złamania, ponieważ mają one o niższej energii. Oznacza to, że musisz zużyć mniej energii, aby złamać niezolarne wiązanie kowalencyjne niż wiązanie jonowe.
Może ci służyć: prawa stechiometrycznePrzykłady niezolarnych łączy kowalencyjnych
H-H łącze w cząsteczce wodoru (H2)
W cząsteczce wodoru, h2, Dwa atomy wodoru dzielą ich jedyne walencyjne elektrony, tworząc proste kowalencyjne wiązanie.
 Cząsteczka wodoru
Cząsteczka wodoru Ponieważ oba atomy są takie same, różnica w elektrowni między nimi wyniesie zero, więc ten link jest nietopolarnym wiązaniem kowalencyjnym.
F-F łącze w cząsteczce fluorowej (F2)
Ten przykład podkreśla fakt, że nie ma znaczenia elektronialiczność atomu, ale różnica w elektroengatymie dwóch atomów, które tworzą łącze, aby wiedzieć, czy łącze będzie kowalencyjne, a nie polarne, czy nie.
 Cząsteczka fluorowa
Cząsteczka fluorowa Fluor jest najbardziej elektroonegatywnym elementem układu okresowego, więc ma tendencję do zdejmowania swoich elektronów z innych elementów, tworząc wiązania polarne lub jonowe.
Jednak gdy atom fluorku jest powiązany z innym równym mu, ani nie może usunąć elektronów z drugiego (nie ma różnicy w elektroonywatywności), więc nie mają one wyboru, jak tylko podzielić się nimi, a zatem formuje się, tworząc, a zatem uformuj A Niepolarne kowalencyjne łącze.
Linki O-O w cząsteczce ozonu (lub3)
Podobnie jak w przypadku cząsteczki fluorowej, tlen jest również bardzo elektroonegatywnym elementem. Jednak tworząc powiązania z innymi atomami tlenu, tworzy niepolarne wiązania kowalencyjne. Tak jest w przypadku cząsteczki ozonu.
 Cząsteczka ozonu
Cząsteczka ozonu W tym przypadku centralny atom tlenu jest powiązany z dwoma innymi atomami tlenu za pomocą niezarodowych lub apolowych wiązań kowalencyjnych.
Może ci służyć: tlenek magnezu: struktura, właściwości, nomenklatura,N-N Link w cząsteczce azotu (n2)
Cząsteczka azotu zawiera niezarodowe wiązanie kowalencyjne, w którym każdy atom azotu ma trzy walencyjne elektrony zniknęły z drugim.
 Cząsteczka azotu
Cząsteczka azotu Z tego powodu oba atomy mają w sumie trzy pary elektronów, tworząc w ten sposób potrójne wiązanie kowalencyjne.
Linki C-H w cząsteczce metanu (CH4)
Metan jest przykładem nietopolarnego wiązania kowalencyjnego utworzonego między atomami o różnych pierwiastkach, w tym przypadku węgla i wodoru.
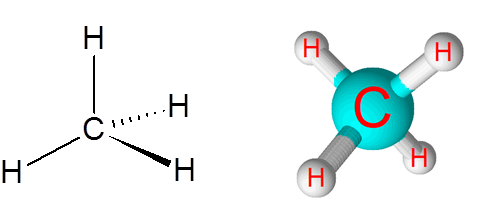 Cząsteczka metanu
Cząsteczka metanu Różnica w elektroonywatywności między dwoma pierwiastkami wynosi 0,4, co umieszcza tę granicę tylko między wiązaniami spolarnymi i polarnymi.
Link c = c w cząsteczce etylenu (c2H4)
Cząsteczka etylenu, zwana również ETENO, ma w sumie pięć linków. Cztery łącza C-H i podwójne wiązanie C = C. W obu przypadkach łącza odpowiadają niezamarodowym lub apolowym wiązaniom kowalencyjnym.
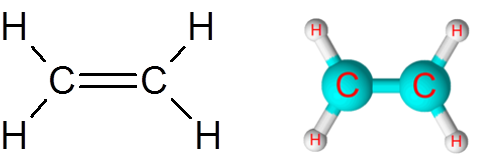 Cząsteczka etylenu
Cząsteczka etylenu
- « 6 tańców i tańców typowych dla Quintana Roo bardziej znanych
- 9 tańców i typowe tańce Michoacán bardziej znane »

