Skoordynowana więź kowalencyjna
- 3399
- 402
- Eliasz Dubiel
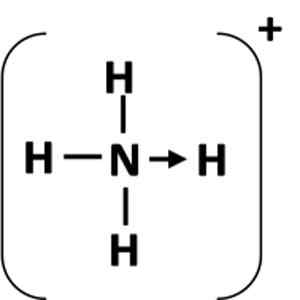
 Ryc. 1: Reprezentacja łącza koordynacyjnego między atomem (N) a akceptorem (H).
Ryc. 1: Reprezentacja łącza koordynacyjnego między atomem (N) a akceptorem (H). Co to jest skoordynowany link kowalencyjny?
A skoordynowana więź kowalencyjna, lub link koordynacyjny, jestRodzaj łącza, w którym jeden z atomów dostarcza wszystkie wspólne elektrony. Nazywa się to również linkiem do celownika lub dwubiegunowego.
W prostym łączu kowalencyjnym każdy atom dostarcza elektron do linku. Z drugiej strony, w linku koordynacyjnym, pojedynczy atom przekazuje elektrony na utworzenie łącza i nazywa się atomem dawcy, podczas gdy atom, który akceptuje parę elektronów do przyłączenia się, nazywa się atomem akceptora.
Łącze koordynacyjne jest reprezentowane przez strzałkę, która zaczyna się od atomów podawania i kończy się na atomie akceptora (ryc. 1). W niektórych przypadkach dawca może być cząsteczką.
W tym przypadku atom w cząsteczce może przekazać parę elektronów, która byłaby podstawą Lewisa, podczas gdy cząsteczka o pojemności akceptora byłaby kwasem Lewis.
Łącze koordynacyjne ma podobne cechy do cech prostej kowalencyjnej wiązania. Związki, które mają ten rodzaj łącza zwykle mają niską temperaturę topnienia i wrzenia, z nieistniejącą interakcją kulombową między atomami (w przeciwieństwie do wiązania jonowego) i związkami są bardzo rozpuszczalne w wodzie.
Niektóre przykłady skoordynowanych kowalencyjnych linków
Najczęstszym przykładem łącza koordynacyjnego jest jon amonowy, który powstaje przez kombinację cząsteczki amoniaku i protonu z kwasu.
Może ci służyć: równanie chemiczne: części i przykładyW amoniaku atom azotu ma samotną parę elektronów po zakończeniu oktetu. Zrobiłem tę samotną parę z jonem wodoru, dlatego atom azotu staje się dawcą. Atom wodoru staje się akceptorem.
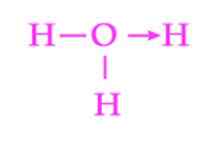 Ryc. 2: Reprezentacja łącza koordynacyjnego jonu hydronio
Ryc. 2: Reprezentacja łącza koordynacyjnego jonu hydronio Innym powszechnym przykładem łącza skrajnego jest tworzenie jonu hydronowego. Podobnie jak w przypadku jonu amonu, para wolnych elektronów cząsteczki wody służy jako dawca protonu, który jest akceptorem (ryc. 2).
Należy jednak pamiętać, że po ustaleniu łącza koordynacyjnego wszystkie hydrogeny przyłączone do tlenu są dokładnie równoważne. Kiedy jon wodoru znów pęknie, nie ma dyskryminacji między tym, który z hydrogenów jest uwalniany.
Doskonałym przykładem reakcji kwasowej kwasowej, która ilustruje tworzenie skoordynowanego wiązania kowalencyjnego jest reakcja tworzenia adduktu trifluorku boru z amoniakiem.
Boro trifluorek to związek, który nie ma szlachetnej struktury gazu wokół atomu Boro. Bor ma tylko 3 pary elektronów w warstwie walencyjnej, więc mówi się, że BF3 jest niedobór w elektronach.
Do przezwyciężenia tego niedoboru można zastosować moment azotowy azotu amoniaku.
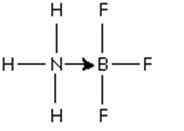 Rycina 3: Addukt między cząsteczką trifluorku boru a amoniakiem
Rycina 3: Addukt między cząsteczką trifluorku boru a amoniakiem Ta para elektronów azotowych jest przekazywana na orbital P pusty boru. Tutaj amoniak jest podstawą Lewisa, a BF3 jest kwasem Lewisa.
Może ci służyć: walencje azotoweChemia koordynacji
Istnieje gałąź chemii nieorganicznej poświęconej wyłącznie badaniu związków, które tworzą metale przejściowe. Te metale wiążą się z innymi atomami lub cząsteczkami poprzez połączenia koordynacyjne w celu tworzenia złożonych cząsteczek.
Cząsteczki te są znane jako związki koordynacyjne, a nauka, która je bada, nazywa się chemią koordynacyjną.
W takim przypadku substancja połączona z metalem, która byłaby dawcą elektronów, jest znana jako podwiązanie i powszechnie do związków koordynacyjnych jest znana jako kompleksy.
Związki koordynacyjne obejmują substancje takie jak witamina B12, hemoglobina i chlorofil, barwniki i pigmenty oraz katalizatory stosowane w przygotowaniu substancji organicznych.
Przykładem złożonego jonu byłby kompleks kobaltu [CO (NH2Ch2Ch2NH2) 2clnh3]2+ To byłby kobalt Dichloroaminethylandiamina (IV).
Chemia koordynacji powstała z pracy Alfreda Wernera, szwajcarskiego chemika, który zbadał różne związki chlorkowe kobaltu (III) i amoniak. Po dodaniu kwasu solnego Werner zaobserwował, że amoniaku nie można całkowicie wyeliminować. Następnie zaproponował, aby amoniak był bardziej powiązany z centralnym kobaltem.
Jednak po dodaniu wodnego azotanu srebra, jednym z utworzonych produktów był chlorek srebra stałego. Ilość utworzonego chlorku srebra była związana z liczbą cząsteczek amoniaku związanych z chlorkiem kobaltu (III).
Na przykład, gdy do Cocl dodano azotan srebra3 · 6nh3, Trzy chlorki stały się chlorkiem srebrnym.
Jednak po dodaniu azotanu srebra do COCL3 · 5nh3, Tylko 2 z 3 chlorków utworzyło chlorek srebrny. Kiedy był Cocl3.4nh3 Z azotanem srebra, jeden z trzech chlorków wytrącał się jako chlorek srebra.
Może ci służyć: kwas panie: co to jest, struktura, synteza, właściwościPowstałe obserwacje sugerowały tworzenie złożonych związków lub koordynacji. W wewnętrznej sferze koordynacyjnej, która jest również określana w niektórych tekstach jako pierwsza kula, ligandowie są bezpośrednio zjednoczeni z centralnym metalem.
W zewnętrznej sferze koordynacyjnej, czasem nazywanej drugiej kuli, inne jony są przymocowane do jonu kompleksu. Werner otrzymał Nagrodę Nobla w 1913 roku za swoją teorię koordynacji.
Ta teoria koordynacji powoduje, że metale przejściowe mają dwa rodzaje Walencji: pierwszą walencję, określoną przez liczbę utleniania metalu, a drugą walencję zwaną liczbą koordynacji.
Numer utleniania mówi, ile wiązań kowalencyjnych można utworzyć w metalu (przykład żelazo (II) wytwarzają brzydkie), a numer koordynacyjny mówi, ile łączy koordynacyjnych można utworzyć w kompleksie (przykład, żelazo z numerem koordynacyjnym produkuje [FECL [FECL [FECL [FECL [FECL [FECL4]- i [Fecl4]2-).
W przypadku kobaltu ma on koordynację numer 6. Dlatego w eksperymentach Wernera, dodając azotan srebra, zawsze otrzymywano ilość chlorku srebra, które pozostawiono heksakoordynowany kobalt.
Połączenia koordynacyjne tego rodzaju związku mają charakterystykę kolorowania.
W rzeczywistości są odpowiedzialne za typowe zabarwienie związane z metalem (czerwone żelazo, niebieski kobalt itp.) i są ważne dla spektrofotometrycznych prób absorpcji i emisji atomowej.
Bibliografia
- Wiązanie chemiczne. Odzyskane z Britannica.com.
- Koordynuj wiązanie kowalencyjne (s.F.). Odzyskane z chemii.Tutorvista.

