Słaba koncepcja elektrolitów, charakterystyka, przykłady
- 2581
- 730
- Herbert Wróblewski
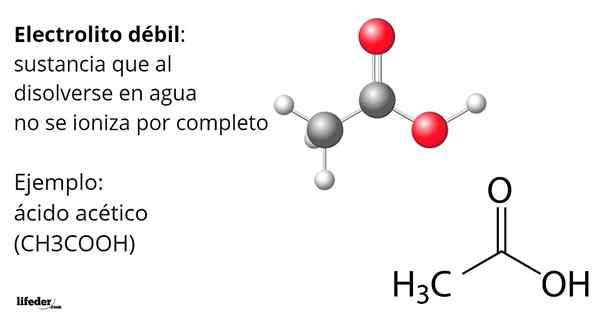
A Słaby elektrolit To wszystko, co substancja rozpuszcza się w wodzie, nie jest całkowicie jonizowana. Oznacza to, że jego rozwiązanie wytwarza lub uwalnia niższe ilości jonów, niż można się było spodziewać. Ten proces jonizacji jest ustalany przez równowagę hydrolizy, w której powstają jony takie jak H3ALBO+ lub och-.
Słabe elektrolity są zwykle związkami kowalencyjnymi, których cząsteczki zwykle pozostają neutralne bez uzyskiwania obciążeń jonowych. Wiele z tych elektrolitów składa się z cząsteczek organicznych z jonizowalnymi grupami funkcjonalnymi, chociaż istnieją również typy nieorganiczne, w tym kilka oksyków.

Kwas octowy, cho3COOH, jest przykładem słabego elektrolitu. Jego cząsteczka ma grupę funkcjonalną, która charakteryzuje jej kwasowość w wodzie. Jednak gdy nie wszystkie jego cząsteczki są rozpuszczane3ALBO+ transformacja w anionie octanowym, Cho3Gruchać-, ale pozostają neutralne, protonowane.
Niektóre elektrolity są słabsze niż inne, co będzie zależeć od stopnia ich jonizacji. Kiedy się rozpuszczają, powodują umiarkowane zmiany w pH. Zatem mamy kwaśne lub podstawowe słabe elektrolity.
[TOC]
Charakterystyka słabych elektolitów
Są kowalencyjnymi związkami
Ogólnie rzecz biorąc, słabe elektrolity są związkami kowalencyjnymi, więc ich jednostki składowe są cząsteczkami.
Cierpią hydrolizę
Te cząsteczki mają zdolność do pozyskiwania obciążeń jonowych. Aby to zrobić, weź udział w równowadze hydrolizy, w której cząsteczka wody jest „częścią” w OH-, lub zaakceptuj wodór, aby przekształcić się w H3ALBO+.
Im mniej prawdopodobny lub niestabilny to hydroliza, tym niższa ilość lub stężenia jonów obecnych w rozpuszczaniu tych elektrolitów.
Mają niską przewodność
Roztwory słabych elektrolitów nie są tak dobrymi przewodnikami energii elektrycznej, w porównaniu do roztworów silnych elektrolitów. Wynika to dokładnie z najniższej liczby jonów w roztworze, co utrudnia przekazanie elektronów przez wodę.
Może ci służyć: manganiczny lub kwas nadmanżowyPrzykłady słabych elektrolitów
 Kwas octu octu jabłkowego jest najbardziej reprezentatywnym przykładem słabego elektrolitu. Źródło: Pxhere.
Kwas octu octu jabłkowego jest najbardziej reprezentatywnym przykładem słabego elektrolitu. Źródło: Pxhere. Kwas węglowy
Cząsteczka kwasu węglowego, h2WSPÓŁ3, Podczas rozpuszczania się w wodzie cierpi na następującą reakcję hydrolizy:
H2WSPÓŁ3 + H2Lub ⇌ HCO3- + H3ALBO+
Problem polega na tym, że nie wszystkie H2WSPÓŁ3 Jest jonizowany w HCO3-. Ponadto H2WSPÓŁ3 Sam dysproporcja w dwutlenku węgla i wodzie, co dodatkowo zmniejsza przewodność tego roztworu.
W przypadku pozostałych przykładów fakt ten będzie recydycja: cząsteczka, która zasadniczo jest neutralna, nabywa obciążenie jonowe, aw procesie za pośrednictwem hydrolizy istnieją jony h3ALBO+ lub och-.
AmonSiemaAC
Cząsteczka amoniaku, NH3, Podczas rozpuszczania się w wodzie cierpi na następującą reakcję hydrolizy:
NH3 + H2Lub ⇌ nh4+ + Oh-
Te roztwory amoniaków strzelają ostrym zapachem.
Tym razem mamy jony-. Amoniak jest słabą zasadą, podczas gdy kwas węglowy, słaby kwas. Dlatego kwasy i słabe zasady są klasyfikowane jako słabe elektrolity, ponieważ są one częściowo zjonizowane bez uwalniania wysokich stężeń hone3ALBO+ lub och-, odpowiednio.
DOKwas fosfalbobogaty
Kwas fosforowy, h3PO4, Jest to przykład słabego okacidu, który z kolei jest elektrolitem:
H3PO4+ H2Lub ⇌ h2PO4- + H3ALBO+
Kwas fosforowy jest nadal w stanie ponieść dwa inne dysocjacje, po jednym dla każdego wodoru kwasowego (łącznie trzy). Stężenie H3ALBO+ Wyprodukowany jest mniejszy w porównaniu do silnego oksoacidu, takiego jak kwas azotowy, HNO3, który jest silnym elektrolitem. Im słabszy elektrolit, tym mniej kwaśne lub podstawowe będzie.
HydalboGeno
Fluor wodoru, HF, jest przykładem nieorganicznego kowalencyjnego związku, który bez oksoacidów jest słabym elektrolitem, ponieważ jest słabym kwasem. Podczas rozpuszczania się w wodzie wytwarza się kwas fluorowy, który jest częściowo zjonizowany:
Może ci służyć: wodorotlenek kobaltuHF+ H2Lub ⇌ f- + H3ALBO+
Pomimo tego, że nie jest silnym elektrolitem, kwas fluorkowy jest zdolny do „jedzenia” szklanki materiałów, które są powszechnie stosowane do przechowywania roztworów kwasowych.
Pirydyna
Pirydyna, c5H5N, jest aminą, która jest hydrolizowana do tworzenia jonów oh-:
C5H5N + h2Lub ⇌ c5H5NH + + Oh-
Pirydyna jest bardziej podstawowa niż amoniak, więc jej jonizacja będzie większa i dlatego wytworzy większe stężenia jonów OH-.
DOKwas cianhSiemaDrico
Kwas cyjanhydowy, HCN, jest także kolejnym przykładem słabego kwasu i elektrolitu:
HCN + H2Lub ⇌ cn- + H3ALBO+
Nierozpuszczalne sole
Ten punkt jest kontrowersyjny. Jak dotąd słabe elektrolity zostały sklasyfikowane jako słabe kwasy lub zasady, charakteryzujące się ich częściowymi jonizacją. Jednak nierozpuszczalne sole w wodzie, które są już jonizowane w ich kryształach, zostały również uważane za słabe elektrolity.
Podczas rozpuszczania się z trudem w wodzie ilość jonów, które uwalniają w roztworze, jest niewielka w porównaniu z ilością rozpuszczalnych soli. W tym sensie nierozpuszczalne sole wytwarzają mniej przewodzące roztwory, które przyćmienia je nieco jako silne elektrolity.
Z tego powodu założono, że sole te należą do grupy słabej elektrolity.
Srebrny chlorek
Chlorek srebra, AGCL, rozpuszcza się w wodzie w celu produkcji jonów Ag+ i Cl-. Jest to jednak dość nierozpuszczalna sól. Ilość uwalnianych jonów jest znacznie niższa niż to, co miałoby, gdyby były całkowicie rozpuszczalne, jak w przypadku azotanu srebra, Agno3, Silny elektrolit.
Może ci służyć: rozproszona fazaWęglan wapnia
Węglan wapnia, caco3, Jest to nierozpuszczalna sól, która przez rozpuszczenie częściowo wytwarza jony CA2+ i co32-. Ta sól, w przeciwieństwie do AGCL, jest podstawowa, ponieważ CO32- jest hydrolizowany do generowania jonów oh-.
Siarczan cynku
Siarczan cynku, stref4, Jest częściowo rozpuszczony w wodzie, aby wytwarzać jony Zn2+ A więc42-.
Fluor wapnia
Fluor wapnia, CAF2, Naturalnie znaleziony jako minerał fluorytowy, rozpuszcza się tylko w wodzie, aby wytworzyć jony CA2+ i f-.
Tlenek magnezu
Tlenek magnezu, MGO, jest raczej nierozpuszczalnym związkiem jonowym w wodzie. Mała część, która się rozpuszcza, reaguje w celu przekształcenia w odpowiedni wodorotlenek, mg (OH)2, który jest naprawdę odpowiedzialny za pojawienie się jonów MG2+ I och-.
Dlatego MGO, pomimo bycia jonowym, nie można zaklasyfikować jako silny elektrolit, ponieważ w wodzie nie uwalnia jonów własnych kryształów (Mg2+ I2-).
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Chung & Chieh. (5 czerwca 2019). Elektrolity. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Helmestine, Todd. (11 lutego 2020). Słaba definicja i przykład elektrolitu. Odzyskane z: Thoughtco.com
- Danielle Reid. (2020). Słaby elektrolit: definicja i przykład. Badanie. Odzyskane z: Study.com

