Struktura dwutlenku siarki (SO2), właściwości, zastosowania, ryzyko

- 1109
- 62
- Estera Wojtkowiak
On dwutlenek siarki Jest to gazowy związek nieorganiczny utworzony przez siarkę i2. Jest to bezbarwny gaz z irytującym i duszącym zapachem. Ponadto jest to rozpuszczalne w wodzie roztwory kwasowe. Wulkany wydają go w kierunku atmosfery podczas erupcji.
Jest częścią biologicznego i geochemicznego cyklu siarki, ale jest wytwarzany w dużych ilościach przez niektóre działania człowieka, takie jak rafinacja oleju i płonących paliw kopalnych (na przykład węgiel lub olej napędowy).
 Dwutlenek siarki SO2 jest wydawany przez wulkany podczas erupcji. Brocken inaglory [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Dwutlenek siarki SO2 jest wydawany przez wulkany podczas erupcji. Brocken inaglory [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. SO2 Jest to czynnik redukujący, który pozwala papierowej miazgi pozostać białą po praniu pieniędzy z innymi związkami. Służy również do wyeliminowania szczątków chloru w wodzie, która została poddana traktowaniu tym chemikiem.
Służy do przechowywania niektórych rodzajów żywności, do dezynfekcji pojemników, w których występuje fermentacja soku winogronowego, aby produkować wino lub jęczmień, aby zrobić piwo.
Jest również wykorzystywany jako grzybobójca w rolnictwie, w celu uzyskania kwasu siarkowego, jako rozpuszczalnik i jako pośrednik w reakcjach chemicznych.
SO2 Obecne w atmosferze jest szkodliwe dla wielu roślin, w wodzie wpływa ryba, a także jest jednym z tych odpowiedzialnych za „kwasowy deszcz”, który koroduje materiały stworzone przez człowieka.
[TOC]
Struktura
Cząsteczka dwutlenku siarki jest symetryczna i tworzy kąt. Kąt jest tak, ponieważ SO2 Ma kilka samotnych elektronów, to znaczy elektronów, które tworzą łącze z dowolnym atomem, ale są wolne.
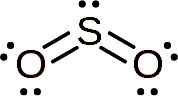 Lewis Struktura dwutlenku siarki, w której obserwuje się jego kształt kątowy i parę wolnych elektronów. Whittlemario [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Lewis Struktura dwutlenku siarki, w której obserwuje się jego kształt kątowy i parę wolnych elektronów. Whittlemario [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Nomenklatura
- Dwutlenek siarki
- Bezwodnik siarki
- Tlenek siarkowy.
Nieruchomości
Stan fizyczny
Bezbarwny gaz.
Waga molekularna
64,07 g/mol
Temperatura topnienia
-75,5 ° C
Punkt wrzenia
-10,05 ° C
Gęstość
Gaz: 2,26 do 0 ° C (w stosunku do powietrza, to znaczy gęstość powietrza = 1). Oznacza to, że jest cięższy niż powietrze.
Ciecz: 1,4 A -10 ° C (w stosunku do wody, to znaczy gęstość wody = 1).
Rozpuszczalność
Rozpuszczalna w wodzie: 17,7% w 0 ° C; 11,9% w 15 ° C; 8,5% w 25 ° C; 6,4% w 35 ° C.
Rozpuszczalne w etanolu, eterze dietelowym, acetonie i chloroformie. Jest mniej rozpuszczalny w rozpuszczalnikach nieolarnych.
Ph
Wodne rozwiązania SOS2 Są kwaśni.
Właściwości chemiczne
SO2 Jest to silny środek redukujący i utleniający. W obecności powietrza i katalizatora utlenia się3.
południowy zachód2 + ALBO2 → Więc3
Pary samotnych elektronów sprawiają, że czasami zachowują się jako podstawa Lewisa, innymi słowy, może reagować ze związkami, w których występuje atom, którego brakuje elektronów.
Może ci służyć: zgłoszenie żelaza: właściwości, sposób, w jaki są wytwarzane, toksyczność, użyciaW takim razie2 Jest w postaci gazu i suchego nie atakuje żelaza, stali, stopu miedzianego-nickel ani niklu-chromu. Jeśli jednak jest w stanie płynnym lub wilgotnym, powoduje korozję tych metali.
SO2 Ciecz o 0,2% wody lub więcej wytwarza silną korozję żelaza, mosiądzu i miedzi. Jest żrący dla aluminium.
Kiedy jest płynny, możesz również zaatakować niektóre tworzywa sztuczne, gumę i powłoki.
Wodny SOS2
SO2 Jest bardzo rozpuszczalny w wodzie. Przez długi czas uważano, że w kwasie siarki wodnej tworzy się h2południowy zachód3, Ale istnienie tego kwasu nie zostało wykazane.
W So Solutions2 W wodzie występują następujące salda:
południowy zachód2 + H2Lub ⇔ SO2.H2ALBO
południowy zachód2.H2Lub ⇔ HSO3- + H3ALBO+
Hso3- + H2Lub ⇔ SO32- + H3ALBO+
Gdzie hso3- Jest to jon bisulfitowy i SO32- Jest to jon siarkowy. Sulfit jon tak32- Występuje głównie wtedy, gdy alkalia jest dodawana do roztworu SO2.
Wodne rozwiązania SOS2 Mają właściwości zmniejszające, zwłaszcza jeśli są alkaliczne.
Inne właściwości
- Jest wyjątkowo stabilny w porównaniu do ciepła, nawet do 2000 ° C.
- To nie jest łatwopalne.
Uzyskanie
SO2 Jest uzyskiwany przez spalanie siarki w powietrzu, chociaż tworzone są również niewielkie ilości takiej formy3.
S + o2 → Więc2
Można go również wytwarzać przez ogrzewanie w powietrzu różnych siarków, spalanie minerałów pirytu i minerałów zawierających siarki, między innymi.
W przypadku pirytu żelaza, po utlenianiu tlenku żelaza (III) i uzyskiwaniu SO2:
4 fes2 + 11 o2 → 2 Wiara2ALBO3 + 8 Tak2↑
Obecność w naturze
SO2 Jest uwalniany do atmosfery przez aktywność wulkanów (9%), ale również pochodzi z innych naturalnych działań (15%) i przez ludzkie działania (76%).
Wybuchowe erupcje wulkaniczne powodują znaczące roczne fluktuacje lub zmiany2 w atmosferze. Szacuje się, że 25% SO2 emitowany przez wulkany jest myte przez deszcz przed dotarciem do stratosfery.
Naturalne źródła są najbardziej obfite i są spowodowane biologicznym cyklem siarki.
Na obszarach miejskich i przemysłowych dominują źródła ludzkie. Główną działalnością człowieka, która ją wytwarza, jest spalanie paliw kopalnych, takich jak węgiel, benzyna i olej napędowy. Inne źródła ludzkie to rafinerie ropy, rośliny chemiczne i produkcja gazu.
 Działania człowieka, takie jak spalanie węgla dla energii elektrycznej, są źródłem zanieczyszczenia2. ADREM68 [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Działania człowieka, takie jak spalanie węgla dla energii elektrycznej, są źródłem zanieczyszczenia2. ADREM68 [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. U ssaków jest generowany w endogeniczny sposób, to znaczy w ciele zwierząt i ludzi z powodu metabolizmu aminokwasów zawierających siarkę, zwłaszcza L-cysteinę.
Może ci służyć: płynne elementy: jakie są i przykładyAplikacje
W produkcji kwasu siarkowego
Jedno z najważniejszych zastosowań SO2 Otrzymuje kwas siarkowy H2południowy zachód4.
2 Tak2 + 2 godz2Lub + o2 → 2 godz2południowy zachód4
W przetworzonym przemyśle spożywczym
Dwutlenek siarki jest stosowany jako konserwujący i stabilizator żywności, jako środek kontroli wilgoci oraz jako modyfikator smaku i tekstury niektórych jadalnych produktów.
Służy również do dezynfekującego sprzętu, który wchodzi w kontakt z artykułami spożywczymi, sprzętem fermentacyjnym, takimi jak browary i niezbędne, pojemniki na żywność itp.
Umożliwia oszczędzanie owoców i warzyw, zwiększa swój żywotność na półce supermarketowej, zapobiega utratę koloru i smaku oraz pomaga w zatrzymaniu witaminy C (kwas askorbinowy) i karotenu (prekursory witaminy A).
 Suszone owoce pozostają wolne od grzybów i bakterii dzięki SO2. Autor: Isabel Ródenas. Źródło: Pixabay.com
Suszone owoce pozostają wolne od grzybów i bakterii dzięki SO2. Autor: Isabel Ródenas. Źródło: Pixabay.com Służy do utrzymania wina, ponieważ niszczy bakterie, grzyby i niechciane drożdże. Służy również do sterylizacji i zapobiegania tworzeniu się nitrozoamin w piwie.
 Sprzęt fermentacyjny jęczmienia w celu uzyskania sterylizacji piwa2. Autor: Ceridebbie. Źródło: Pixabay.
Sprzęt fermentacyjny jęczmienia w celu uzyskania sterylizacji piwa2. Autor: Ceridebbie. Źródło: Pixabay. Służy również do namoczenia ziaren kukurydzy, do wybielacza cukru buraków i jako przeciwdrobnoustrojowego w produkcji syropu kukurydzianego o wysokiej fruktozie.
Jako rozpuszczalnik i reakcyjny
Był powszechnie stosowany jako rozpuszczalnik nieodowiskujący. Chociaż nie jest to rozpuszczalnik jonizujący, jest użyteczny jako rozpuszczalnik wolny od protonów do niektórych zastosowań analitycznych i reakcji chemicznych.
Jest stosowany jako rozpuszczalnik i odczynnik w organicznym, pośredniego w produkcji innych związków, takich jak dwutlenek chloru, chlorek acetylu i sulfonacja oleju.
Jako agent redukujący
Jest stosowany jako środek redukujący, mimo że nie jest tak silny, aw roztworze alkalicznym powstaje jon siarczkowy, który jest bardziej energetycznym środkiem redukującym.
W kilku aplikacjach
SO2 Jest również używany:
- W rolnictwie, takich jak środki fungicydowe i ochrony winogron po zbiorze.
- Do produkcji hydrosulfitu.
- Wybielają się w pulpie drewna i papieru, ponieważ umożliwia stabilizację miazgi po praniu za pomocą nadtlenku wodoru H2ALBO2; SO2 Działania, niszcząc H2ALBO2 resztki, a tym samym zachować jasność miazgi, jak h2ALBO2 może spowodować odwrócenie jasności.
- Bludzić włókna tekstylne i wiklinowe artykuły.
- Aby leczyć wody, eliminuje resztkowy chlor, który pozostaje po chlorowaniu wody pitnej, ścieków lub wód przemysłowych.
- W rafinacji minerałów i metali, jako środek redukujący żelazo podczas przetwarzania minerałów.
- W rafinacji oleju w celu złapania tlenu i opóźnienia korozji oraz jako rozpuszczalnik ekstrakcji.
Może ci służyć: równoważenie równań chemicznych- Jako przeciwutleniacz.
- Jako neutralizator Alkalis w produkcji szkła.
- W akumulatorach litowych jako środek utleniający.
Efekty tego2 endogenny
Niektóre badania ujawniły, że SO2 Endogenny lub wytwarzany przez sam organizm ma korzystny wpływ na układ sercowo -naczyniowy, w tym regulację funkcji serca i rozluźnienie naczyń krwionośnych.
Kiedy SO występuje w organizmie2 Staje się jego pochodnymi Bisulfite Hso3- i siarczan tak32-, które wywierają efekt Vasorelajador tętnic.
SO2 Endogenne zmniejsza nadciśnienie, zapobiega rozwojowi miażdżycy i chroni serce uszkodzenia mięśnia sercowego. Wywiera również działanie przeciwutleniające, hamuje zapalenie i apoptozę (zaprogramowana śmierć komórki).
Z tych powodów uważa się, że może to być możliwa nowa terapia chorób sercowo -naczyniowych.
 Serce może skorzystać z SO2 wyprodukowane przez organizm. Autor: OpencLipart-Vectors. Źródło: Pixabay.
Serce może skorzystać z SO2 wyprodukowane przez organizm. Autor: OpencLipart-Vectors. Źródło: Pixabay. Ryzyko
- Narażenie na to2 Gaza może prowadzić do oparzeń w oczach, skórze, gardle i błonach śluzowych, uszkodzenia oskrzeli i płuc.
- Niektóre badania podają, że ma potencjalne ryzyko uszkodzenia materiału genetycznego komórek ssaków i ludzkich.
- To jest żrące. To nie jest łatwopalne.
Ekotoksyczność
Dwutlenek siarki jest najczęstszym gazem zanieczyszczeń w atmosferze, szczególnie na obszarach miejskich i przemysłowych.
Jego obecność w atmosferze przyczynia się do „kwaśnego deszczu”, który jest szkodliwy dla organizmów wodnych, ryb, roślinności lądowej i korozji dla materiałów wykonanych przez człowieka.
 Pomnik uszkodzony przez kwasowy deszcz. Nino Barbieri [CC BY-S (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons.
Pomnik uszkodzony przez kwasowy deszcz. Nino Barbieri [CC BY-S (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons. SO2 Łowić ryby toksyczne. Zielone rośliny są wyjątkowo wrażliwe na to2 atmosferyczny. Lucerna, bawełna, jęczmień i pszenica są uszkodzone przy niskim poziomie środowiska, podczas gdy ziemniaki, cebula i kukurydza są znacznie bardziej odporne.
Wpływ spożycia go z jedzeniem
Chociaż jest to nieszkodliwe dla zdrowych ludzi, stosowane w stężeniach zalecanych przez autoryzowane agencje zdrowotne, SO2 może skłonić astmę do wrażliwych ludzi, którzy spożywają ją z jedzeniem.
 Wrażliwi ludzie mogą cierpieć na astmę, spożywając jedzenie z niewielką ilością2. Suraj w Malajalam Wikipedia [domena publiczna]. Źródło: Wikimedia Commons.
Wrażliwi ludzie mogą cierpieć na astmę, spożywając jedzenie z niewielką ilością2. Suraj w Malajalam Wikipedia [domena publiczna]. Źródło: Wikimedia Commons. Pokarmy, które zwykle go zawierają, to suszone owoce, sztuczne napoje bezalkoholowe i napoje alkoholowe.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Siarka dwutlenku. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Huang i. i in. (2016). Endogenny dwutlenek siarki: nowy łagodny rodzina benzynowo -twórczych w układzie sercowo -naczyniowym. Oxid Med Cell Longev. 2016; 2016: 8961951. NCBI odzyskało.NLM.Nih.Gov.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Windholz, m. i in. (redaktorzy) (1983). Indeks Merck. Enyklopedia chemikaliów, leków i biologicznych. Wydanie dziesiąte. Merck & Co., Inc.
- Chleb, x. (2011). Tlenki siarki: źródła, ekspozycje i skutki zdrowotne. Skutki zdrowotne tlenków siarki. W Encyklopedii zdrowia środowiskowego. Odzyskane z naukowym.com.
- Tricker, R. i Torker, S. (1999). Zanieczyszczenia i zanieczyszczenia. Dwutlenek siarki. W wymaganiach środowiskowych dotyczących urządzeń elektromechanicznych i elektronicznych. Odzyskane z naukowym.com.
- BLEAM, W. (2017). Chemia kwasowo-zasadowa. Tlenki siarki. W chemii gleby i środowiska (wydanie drugie). Odzyskane z naukowym.com.
- Freedman, ur.J. (1980). Dwutlenek siarki w żywności i napojach: jego użycie konserwujący i jego wpływ na astmę. Br J Dis Chest. 1980; 14 (2): 128-34. NCBI odzyskało.NLM.Nih.Gov.
- Craig, k. (2018). Przegląd chemii, używania pestycydów i losu środowiskowego dwutlenku siarki, zastosowanej w Kalifornii. W przeglądzie zanieczyszczenia środowiska i toksykologii. Tom 246. Link odzyskał.Skoczek.com.
- « Struktura krzemowa nitruro (SI3N4), właściwości, uzyskiwanie, użycia
- Aluminiowa struktura polilorydu, właściwości, uzyskiwanie, zastosowania »

