Struktura dimetyloinyloiny, właściwości, synteza,
- 2234
- 354
- Arkady Sawicki
dimetyloinylina o Dimetilphenylamina to związek organiczny, który powstaje przez pierścień benzenowy z grupą aminową zastąpioną dwiema grupami metylowymi. Jego formuła chemiczna to c8HjedenaścieN.
Jest również znany jako N, N-dimetyloinylina, ponieważ jest pochodną Anylin, w której hydrogeny grup aminowych są zastępowane dwiema grupami metylowymi. To sprawia, że jest to trzeciorzędowa amina.
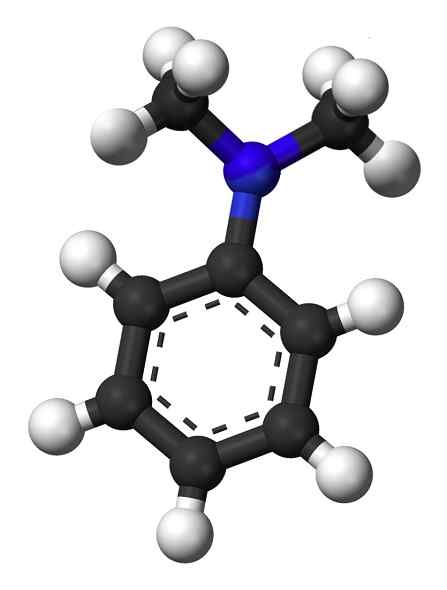
 Struktura N, N-dimetyloyloiny. Nie dostarczył autora, który można odczytać w maszynie. Mysid założył (na podstawie roszczeń dotyczących praw autorskich). [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikipedia Commons.
Struktura N, N-dimetyloyloiny. Nie dostarczył autora, który można odczytać w maszynie. Mysid założył (na podstawie roszczeń dotyczących praw autorskich). [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikipedia Commons. N, n-dimetyloinylinę to jasnożółta do brązowego tłustego cieczy z charakterystycznym zapachem amin. Jest to podstawowy związek i reaguje z kwasem azotowym tworzącym nitrosokomponowany. Po wystawieniu na powietrze staje się brązowy.
Jest stosowany w produkcji barwników do obrazów. Jest również stosowany jako aktywator katalizatorów polimeryzacji i w mieszaninach używanych do nagrywania obrazu. Z kolei zastosowano go w syntezie związków przeciwbakteryjnych lub antybiotyków jako niektórych cefalosporyny pochodzących z penicyliny. N, n-dimetyloinylina jest również podstawą do uzyskania innych związków chemicznych.
Jest to spalana ciecz, a gdy jest podgrzewana, dopóki rozkład emituje toksyczne opary. Ostra ekspozycja człowieka na N, N-dimetyloinylinę może prowadzić do negatywnych skutków, takich jak bóle głowy, zawroty głowy, spadek tlenu we krwi i niebieskawe zabarwienie skóry, między innymi objawy,.
[TOC]
Struktura
Poniższy rysunek pokazuje strukturę przestrzenną N, N-dimetyloinyliną:
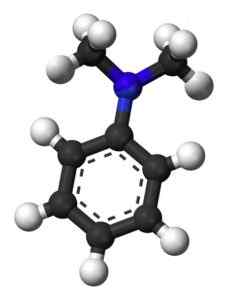 Struktura przestrzenna N, N-dimetyloinylin. Esquilo [domena publiczna]. Źródło: Wikipedia Commons.
Struktura przestrzenna N, N-dimetyloinylin. Esquilo [domena publiczna]. Źródło: Wikipedia Commons. Nomenklatura
- N, N-dimetyloinylina
- Dimetyloinylina
- Dimetylofenylaminę
- N, n-dimetylo-bencenamina
N jest umieszczany w nazwie, aby wskazać, że dwie grupy metylowe (-ch3) są przyczepione do azotu (n), a nie do pierścienia Benncénico.
Nieruchomości
Stan fizyczny
Blada do brązowego płynu.
Waga molekularna
121,18 g/mol.
Może ci służyć: anion: trening, cechy i typyTemperatura topnienia
3 ° C.
Punkt wrzenia
194 ° C.
Temperatura zapłonu
63 ° C (metoda zamkniętej kubka). Jest to minimalna temperatura, w której opary można włączyć, jeśli przekazany jest płomień.
Ciśnienie pary
0,70 mm Hg w 25 ° C.
Temperatura samo -kierunkowego
371 ° C. Jest to minimalna temperatura przy spontanicznie spalanym ciśnieniu atmosferycznym, bez zewnętrznego źródła ciepła lub płomienia.
Gęstość
0,9537 g/cm3 w 20 ° C.
Współczynnik załamania światła
15582 do 20 ° C.
Rozpuszczalność
W wodzie jest bardzo mało rozpuszczalny: 1454 mg/L A 25 ° C.
Swobodnie rozpuszczalny w alkoholu, chloroformu i eterze. Rozpuszczalne w acetonu, benzenie i natlenionych i chlorowanych rozpuszczalnikach.
Stała podstawowa
KB 11.7, co wskazuje na łatwość, z jaką ten związek akceptuje jon wodoru wody.
Właściwości chemiczne
N, n-dimetylolanina jest podstawowym związkiem. Reaguje z kwasem octowym, aby dać octan n, n-dimetilanilinio.
Grupa -n (wybierz3)2 N, N-dimetyloinylina jest potężnym aromatycznym aktywatorem podstawienia w pozycji Do pierścienia benzenu.
Reaguje z azotynem sodu (nano2) W obecności kwasu solnego (HCl) tworzącego p-nitrozo-N, n-dimetyloinylinę. Również w przypadku kwasu azotowego wytwarza ten sam związek nitrosado w pozycji Do.
Podczas reakcji N, N-dimetilanilinu z chlorkiem benzezonium, w delikatnie kwaśnej pożywce, występuje azokomponowany typ AR = N-AR, gdzie AR jest grupą aromatyczną. Cząsteczki z grupami AZO to silnie kolorowe związki.
Ryzyko
Po podgrzaniu do jego rozkładu emituje wysoce toksyczne opary tlenków azotuX.
Jest to spalany ciecz.
Rozkłada się powoli w wodzie narażonej na światło słoneczne. Nie jest biodegradowane.
Jest ulatniony mokrą glebą i powierzchnią wody. Nie odparuj suchej gleby i nie poruszaj się przez to. Nie gromadzi się u ryb.
Może ci służyć: siarczek żelaza (ii): właściwości, ryzyko i zastosowaniaMoże być wchłonięte przez skórę. Jest również szybko wchłaniany przez inhalację. Ekspozycja człowieka na N, N-dimetyloiny może zmniejszyć zawartość tlenu w krwi, co powoduje niebieskawowy kolor skóry.
Ostre wdychanie tego związku może prowadzić do negatywnych skutków ośrodkowego układu nerwowego i układu krążenia, z bólem głowy, sinicą i zawrotnością zawrotną.
Synteza
Może wystąpić na kilka sposobów:
- Od anilin i metanolu pod ciśnieniem w obecności katalizatorów kwasowych, takich jak H2południowy zachód4. Uzyskuje się siarczan, który staje się podstawą przez dodanie wodorotlenku sodu.
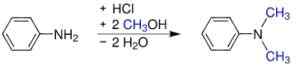 Synteza S, N-dimetyloylina. Werderkli - własna praca. Domena publiczna. Źródło: Wikipedia Commons.
Synteza S, N-dimetyloylina. Werderkli - własna praca. Domena publiczna. Źródło: Wikipedia Commons. - Mijanie pary anilinowej i eteru dimetylowego na aktywowanym tlenku glinu.
- Podgrzewanie mieszaniny anilin, chlorku aniliniowego i metanolu pod ciśnieniem, a następnie destylacja.
Aplikacje
W branży kolorowanki
W przypadku własności reakcji z chlorkiem Bencenodiazonium tworzącym Azocompiestos, N-dimetyloiny jest stosowana jako pośrednik w produkcji kolorowania.
Jest to surowiec w syntezie barwników rodziny metylolinowej.
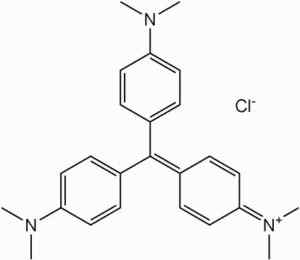 Kolorowanie metyloletowe. Nie dostarczył autora, który można odczytać w maszynie. Zakładany Shaddack (na podstawie roszczeń dotyczących praw autorskich). [Domena publiczna]. Źródło: Wikipedia Commons
Kolorowanie metyloletowe. Nie dostarczył autora, który można odczytać w maszynie. Zakładany Shaddack (na podstawie roszczeń dotyczących praw autorskich). [Domena publiczna]. Źródło: Wikipedia Commons W produkcji fotosytualnych mieszanin
N, N-dimetyloinylina jest częścią fotosytutowalnej mieszaniny, która doświadcza reakcji wyleczenia w wyniku wysokiej wrażliwości na światło widzialne lub bliską podczerwień, dzięki czemu można ją wykorzystać do rejestrowania obrazów lub materiałów fotograficznych lub materiałów fotograficznych.
N, N-dimetyloinylina jest jednym ze składników mieszaniny, która powoduje świadomość długości fali, tak że skład jest utwardzany za pomocą światła o niskiej energii fali.
Może ci służyć: pochodne benzenuSzacuje się, że funkcja N, N-dimetyloinyloiny ma prawdopodobnie stłumić reakcję zakończenia radykalnej polimeryzacji spowodowanej tlenem.
W produkcji z włókna szklanego
N, N-dimetyloanylina jest stosowana jako szulona katalityczna w niektórych żywicach z włókna szklanego.
W syntezie antybiotyków
N, N-dimetyloanylina uczestniczy w syntezie cefalosporyn opartych na penicylinach.
Sulfotlenki penicyliny są przekształcane w cefemy, gdy ogrzewane są w obecności podstawowych katalizatorów, takich jak N, N-dimetyloyloina.
Te cefalosporyny wykazują aktywność przeciwbakteryjną przeciwko organizmom Gram-dodatnim i Gram-ujemnym, a także przeciwko gronkowaniu odpornym na penicylinę.
 Antybiotyki. Alina Kuptsova. Źródło: Pixabay.
Antybiotyki. Alina Kuptsova. Źródło: Pixabay. Należy jednak zauważyć, że n, n-dimetyloanina pozostaje w tych antybiotykach jako nieczystość.
O reakcjach chemicznych
N, N-dimetyloinylina jest stosowana w aktywacji katalizatorów polimeryzacji olefiny.
Jest używany razem z pentafluorofenolu (c6F5Oh), z którym tworzy związek jonowy [hnphme2]+[H (OC6F5)2]-. Ten związek jonowy ma jeden lub dwa aktywne protony, które aktywują katalizator na podstawie metalu przejściowego.
Dodatkowo w produkcji żywic N-dimetyloinyla została zastosowana jako akcelerator polimeryzacji lub promotor do żywic poliestrowych. Jego działanie generuje szybkie utwardzenie żywicy.
W kilku aplikacjach
Jest stosowany w syntezie innych związków chemicznych, na przykład waniliny i jako pośrednik na leki farmaceutyczne.
Jest również stosowany jako rozpuszczalnik, jako środek alkilujący, jako stabilizator i do produkcji obrazów i powłok.
Bibliografia
- S. National Library of Medicine. (2019). N, n-dimetyloanilina. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Morrison, r.T. i Boyd, r.N. (2002). Chemia organiczna. 6. edycja. Prentice-Hall.
- (2000). N, n-dimetyloanilina. Streszczenie. Pobrano z EPA.Gov
- Zanaboni, s. 1. (1966). Nienasycony składowy składnik poliestrowy stabilność i szybkie utwardzenie w niskich temperaturach przy użyciu mieszaniny dimetyloanilu, trenhanolaminy i difenyloaminy. LUB.S. Patent nr. 3 236 915. 22 lutego 1966.
- Nudelman, a. i McCaully, r.J. (1977). Proces rearanżacji penicylin na cefalosporyny i ich pośrednie kompozycje. LUB.S. Patent nr. 4 010,156. 1 marca 1977.
- Kouji Inaishi (2001). Kompozycja fotosukulna. LUB.S. Patent nr. 6 171 759 B1. 9 stycznia 2001.
- Luo, L. i in. (2012). Kwas joński Bransted. LUB.S. Patent nr. 8 088 952 B2. 3 stycznia 2012.
- « Historia Rodio, właściwości, struktura, zastosowania, ryzyko
- Ostre dźwięki charakterystyki i przykłady »

