Struktura dichlorometanu, właściwości, zastosowania, toksyczność

- 2288
- 456
- Eliasz Dubiel
On Dichlorometan, Znany również jako chlorek metylenowy, jest to związek organiczny, którego wzór chemiczny wynosi CH2Cl2. W szczególności jest to alkilowy halogenek pochodzący z gazu metanu. W przeciwieństwie do metanu, ten związek jest bezbarwną i polarną cieczą.
Początkowo został zsyntetyzowany w 1839 r. Przez francuskiego chemika i fizyka Henri Victora Regnault (1810–1878), którym udało się odizolować go od mieszanki chloru i chlorometanu narażonego na światło słoneczne.
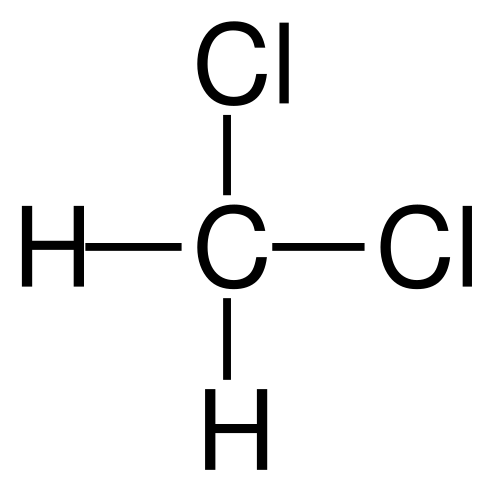 Formuła strukturalna dichlorometanu. Źródło: Jü [domena publiczna]
Formuła strukturalna dichlorometanu. Źródło: Jü [domena publiczna] Dichlorometan występuje przemysłowo przez obróbkę metanu lub chlorometanu z gazem chloru w wysokiej temperaturze (400-500 ° C). Razem z dichlorometanem występują one w procesie chloroformu i tetrachlorku węgla, które są oddzielone przez destylację.
Dichlorometan jest używany jako rozpuszczalnik, który umożliwia spawanie materiałów z tworzywa sztucznego i degrase'u metali. Jest również używany w kawy i bezkofein herbaty.
Dichlorometan jest toksycznym związkiem, który może wytwarzać przez podrażnienie inhalacji nozdrzy i gardła. Uszkodzenie wątroby zgłoszono u narażonych pracowników na wysokie stężenia dichlorometanu. Ponadto jest środkiem mutagennym, podejrzewa się, że jest rakotwórczy.
[TOC]
Struktura
 Struktura molekularna dichlorometanu. Źródło: Gabriel Bolívar przez Molview.
Struktura molekularna dichlorometanu. Źródło: Gabriel Bolívar przez Molview. Na pierwszym obrazie pokazano formułę strukturalną CH2Cl2, w którym wyróżniają się ich kowalencyjne więzi C-H i C-Cl. I jego struktura reprezentowana przez model sfery i prętów. Zwróć uwagę na pierwsze spojrzenie, że wiązania C-H (białe kule) są krótkie, podczas gdy wiązania C-Cl (zielone kule) są długie.
Cho Geometria2Cl2 Jest czworościenny; ale zniekształcone z powodu najbardziej nieporęcznych atomów chloru. Jeden koniec tetrahedronu jest zdefiniowany przez dwa atomy chloru, bardziej elektrowni niż wodór i węgiel. Dlatego w cząsteczce CH2Cl2 Ustalono stały moment dipolowy (1.6d).
Może ci służyć: reakcja neutralizacjiUmożliwia to cząsteczki dichlorometanu oddziaływania ze sobą przez siły dipolowe-dipolo. Podobnie, te interakcje międzycząsteczkowe są odpowiedzialne za istnienie tego związku jako ciecz pomimo jego masy niska cząsteczkowej; Ciecz, który jest jednak dość niestabilny.
Nieruchomości
Wygląd
Bezbarwny płyn.
Masa cząsteczkowa
84,93 g/mol.
Zapach
Słodki, podobny do chloroformu.
Zapach próg
205 - 307 ppm.
Gęstość
1 3266 g/cm3 (20 ° C).
Temperatura topnienia
- 97,6 ºC.
Punkt wrzenia
39,6 ° C.
Rozpuszczalność wody
25,6 g/l przy 15 ° C i 5,2 g/l 60 ° C.
Dichlorometan jest ledwo rozpuszczalny w wodzie. Podczas obu cząsteczek, Cho2Cl2 i H2Lub, są polarne, ich interakcje są prawdopodobnie nieefektywne z powodu odpychania między atomami chloru i tlenu.
Rozpuszczalność w innych rozpuszczalnikach
Mamiczne z octanem etylu, alkoholu, heksanu, benzenu, tetrachlorku węgla, eteru dietetylowego, chloroformu i dimetyloformamidu.
Współczynnik podziału oktanol/wodę
Log p = 1,19.
Ciśnienie pary
57,3 kPa (25 ºC). Ciśnienie odpowiada około 5,66 atm, odzwierciedlając wysokie ciśnienie pary.
Gęstość pary
2,93 w relacji powietrznej wzięte jako 1.
Wskaźnik refrakcji (πd)
1 4244 (20 ° C).
Breja
0,413 CP (25 ° C).
punkt zapłonu
Dichlorometan nie jest łatwopalny, ale po zmieszaniu z powietrzem tworzy łatwopalne opary powyżej 100 ° C.
Temperatura samo -kierunkowego
556 ° C.
Stabilność
Jest stabilny w temperaturze otoczenia przy braku wilgoci, mając względną stabilność w porównaniu z jego kongenerami: chloroform tetrachlorku węgla i tetrachlorkiem.
Ma tendencję do karbonizacji w wysokich temperaturach (300-450 °.
Rozkład
Można go podzielić na kontakt z gorącymi powierzchniami lub płomieniem, emitując toksyczne i irytujące opary fosgenu i chlorku wodoru.
Może ci służyć: elektron różnicowyKorozja
Dichlorometan atakuje niektóre formy tworzyw sztucznych, gumów i powłok.
Ciepło parowe
28,82 kJ/mol A 25 ºC.
Napięcie powierzchniowe
28,20 Dynas/cm w 25 ° C.
Reaktywność
Dichlorometan silnie reaguje z aktywnymi metaliami, takimi jak potas, sód i lit. Reaguje z silnymi zasadami, na przykład Boutekside potasu. Jest niezgodny z substancjami żrącymi, utleniaczami i chemicznie aktywnymi metaliami.
Dodatkowo reaguje z ciekłym tlenem w stopach sodu i potasu oraz tertroksydu azotu. W kontakcie z wodą możesz uruchomić stale nierdzewne, nikiel, miedź, a także żelazo.
Aplikacje
Większość zastosowań i zastosowań dichlorometanu opiera się na jego właściwościach jako rozpuszczalnik. Ze względu na tę cechę dichlorometan jest stosowany w żywności, transporcie, branżach medycyny itp.
Przetwórstwo spożywcze
Dichlorometan jest używany w bezkoledowych ziarnach kawy i liści herbaty. Jest również wykorzystywany do ekstrakcji chmielu do piwa, napojów i innych flag żywnościowych, a także do przetwarzania przypraw.
Przemysł farmaceutyczny
Dichlorometan jest stosowany do przygotowania cefalosporyny i ampicyliny, oprócz produkcji antybiotyków, sterydów i witamin.
Fotografia
Jest również stosowany jako rozpuszczalnik w produkcji triacetanu celulozy (CTA), stosowanego w tworzeniu filmów bezpieczeństwa.
Przemysł elektroniczny
Jest to idealny związek do wytwarzania drukowanych pałek obwodów, przy użyciu powierzchni aluminiowej przed dodaniem fotoretu płytowego.
Malatura
Dichlorometan jest rozpuszczalnikiem występującym w lakierach i separatorach farb, używanych do eliminowania lakierów lub powlekania obrazów różnych rodzajów powierzchni.
Transport
Służy do odtłuszczania metalowych części i powierzchni obecnych w sprzęcie kolejowym, a także w komponentach samolotów.
Może ci służyć: woda destylowanaInne zastosowania
Jest stosowany jako paliwo sprayu (aerozole) i jako środek rozszerzający piankę poliuretanową. Jest również stosowany jako płyn w niektórych rodzajach świateł świątecznych.
Toksyczność
Ostre efekty
Wdychanie dichlorometanu może powodować podrażnienie górnych dróg oddechowych, kaszel, świszczący świszczący lub brak powietrza.
Może powodować zaczerwienienie skóry, a jeśli związek pozostaje na nim długi czas, powodują oparzenia chemiczne. W kontakcie z oczami dichlorometan powoduje poważne podrażnienie, które może rozciągnąć się na oparzenie.
Ponadto działa jako zmiany wizualne, słuchowe i psychomotoryczne generujące neurotoksynę; Ale efekty te są odwracalne do zaprzestania inhalacji dichlorometanu.
Przewlekłe efekty
Dichlorometan może wpływać na ośrodkowy układ nerwowy i generować ból głowy, zamieszanie psychiczne, nudności, wymioty i utratę pamięci.
U zwierząt wywołuje szkodliwy wpływ na wątrobę, nerki, ośrodkowy układ nerwowy i układ sercowo -naczyniowy.
Gdy tylko karcynogeneza nie zgłosiła znacznego wzrostu zgonów z powodu raka u pracowników narażonych na dichlorometan. Jednak badania na zwierzętach wykazały wzrost przypisywania dichlorometanu podczas występowania raka wątroby i płuc, a także łagodnych guzów gruczołów sutkowych.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5ta Wydanie. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- National Center for Biotechnology Information. (2020). Dichlorometan. Baza danych Pubchem., CID = 6344. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2020). Dichlorometan. Źródło: w:.Wikipedia.org
- Brumer. (14 lipca 2018 r.). Dichlorometan. Odzyskany z: Brumer.com
- MSD online. (2019). Dichlorometan (chlorek metylenowy) Zagrożenia i informacje o bezpieczeństwie. Pobrano z: msdSonline.com
- EPA. (2000). Chlorek metylenowy (dichlorometan). [PDF]. Odzyskane z: EPA.Gov
- « Określenie metod i przykładów Ashes
- Tradycje kultury Korei Południowej, zwyczaje, gastronomia, religia »

