Denaturacja białka Co to jest, czynniki, konsekwencje
- 2534
- 633
- Gabriela Łuczak
Jaka jest denaturacja białek?
Denaturacja białka Składa się z utraty trójwymiarowej struktury z powodu różnych czynników środowiskowych, takich jak temperatura, pH lub niektóre środki chemiczne. Utrata struktury powoduje utratę funkcji biologicznej związanej z tym białkiem, zarówno enzymatycznym, strukturalnym, transporterem.
Struktura białka jest bardzo wrażliwa na zmiany. Destabilizacja pojedynczego niezbędnego mostu wodoru może denaturalizować białko. W ten sam sposób istnieją interakcje, które nie są ściśle niezbędne do spełnienia funkcji białka, a w przypadku destabilizowania nie ma wpływu na działanie.
Struktura białka
Aby zrozumieć procesy denaturacji białek, musimy wiedzieć, w jaki sposób zorganizowane są białka. Mają one strukturę pierwotną, wtórną, trzeciorzędową i czwartorzędową.
Struktura pierwotna
To sekwencja aminokwasowa tworzy to białko. Aminokwasy są podstawowymi blokami, które stanowią te biomolekuły i istnieją 20 różnych rodzajów, każdy o szczególnych właściwościach fizycznych i chemicznych. Łączą się za pomocą łącza peptydowego.
Struktura wtórna
W tej strukturze ten liniowy łańcuch aminokwasów zaczyna być składany przez mosty wodorowe. Istnieją dwie podstawowe struktury wtórne: śmigło α, w kształcie spirali; i składany liść β, gdy dwa liniowe łańcuchy są wyrównane równolegle.
Struktura trzeciorzędowa
Obejmuje inne rodzaje sił, które powodują określone składanie formy trójwymiarowej.
Łańcuchy R reszt aminokwasowych, które składają się na strukturę białka, mogą tworzyć mosty disiarczkowe, a hydrofobowe części białek są pogrupowane w środku, podczas gdy hydrofilowe stają się wodą do wody. Siły van der Waalsa działają jako stabilizator opisanych interakcji.
Może ci służyć: izoleucyna: Charakterystyka, funkcje, biosynteza, jedzenieStruktura czwartorzędowa
Składa się z agregatów jednostek białkowych.
Gdy białko jest denaturowane, traci on czwartorzędową, trzeciorzędową i wtórną strukturę, podczas gdy pierwotna pozostaje nienaruszona. Białka bogate w połączenia disiarczkowe (struktura trzeciorzędowa) dają większą oporność na denaturacja.
Czynniki powodujące denaturacja
Każdy czynnik, który destabilizuje wiązania niekowalencyjne odpowiedzialne za utrzymanie natywnej struktury białka, może powodować jej denaturacja. Wśród najważniejszych możemy wspomnieć:
Ph
Przy bardzo ekstremalnych wartościach pH, zarówno kwasowych, jak i podstawowych, białko może stracić swoją trójwymiarową konfigurację. Nadmiar Hones H+ I och- W środku destabilizuje interakcje białkowe.
Ta zmiana wzorca jonów powoduje denaturacja. Denaturacja pH może być w niektórych przypadkach odwracalna, aw innych nieodwracalnych.
Temperatura
Denaturacja termiczna występuje przez zwiększenie temperatury. W organizmach żyjących w średnich warunkach środowiskowych białka zaczynają destabilizować w temperaturach większych niż 40 ° C. Oczywiście termofilowe białka organizmu mogą wspierać te zakresy temperatury.
Wzrost temperatury przekłada się na wzrost ruchów molekularnych, które wpływają na mosty wodorowe i inne niekowalencyjne wiązania, co powoduje utratę trzeciorzędowej struktury.
Te wzrosty temperatury prowadzą do prędkości reakcji, jeśli mówimy o enzymach.
Substancje chemiczne
Substancje polarne - takie jak mocznik - w wysokich stężeniach wpływają na mosty wodorowe. Podobnie substancje nie -spolarne mogą mieć podobne konsekwencje.
Detergenty mogą również destabilizować strukturę białka; Nie jest to jednak agresywny proces i są one w większości odwracalne.
Może ci podać: niemiecki karaluch: cechy, reprodukcja, jedzenieŚrodki redukujące
Β-merkaptoetanol (HOCH2CH2SH) jest częstym stosowaniem środka chemicznego w laboratorium do denaturalizacji białek. Jest odpowiedzialny za zmniejszenie mostów disiarczkowych między odpadami aminokwasowymi. Może destabilizować trzeciorzędową lub czwartorzędową strukturę białka.
Innym środkiem redukującym o podobnych funkcjach jest ditiotreitol (DTT). Ponadto inne czynniki, które przyczyniają się do utraty natywnej struktury w białkach, są metale ciężkie w wysokich stężeniach i promieniowanie ultrafioletowe.
Konsekwencje Denaturacja białka
Gdy zachodzi denaturalizacja, białko traci swoją funkcję. Białka działają optymalnie, gdy są w stanie natywnym.
Utrata funkcji nie zawsze jest powiązana z procesem denaturacji. Niewielka zmiana struktury białka może prowadzić do utraty funkcji bez destabilizacji całej trójwymiarowej struktury.
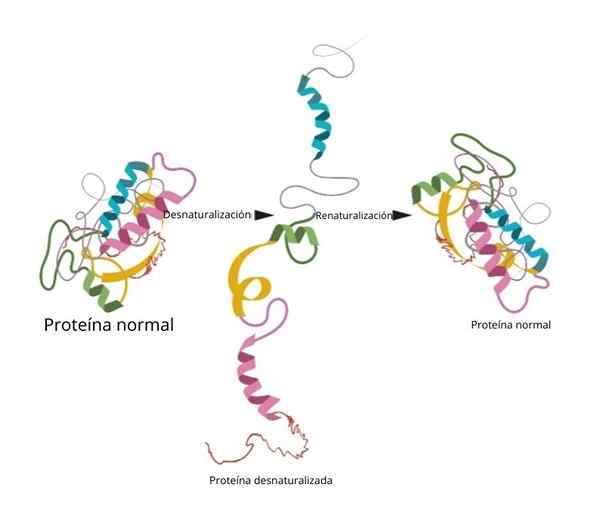
Proces może, ale nie musi być nieodwracalny. W laboratorium, jeśli warunki są odwrócone, że białko powraca do swojej początkowej konfiguracji.
Renaturalizacja
Jeden z najbardziej znanych i rozstrzygających eksperymentów dotyczących renaturalizacji został udowodniony w rybonukleazie.
Kiedy naukowcy dodali środki denaturujące, takie jak mocznik lub β-merkaptanol, białko denaturowano. Gdyby te środki zostały usunięte, białko powróciło do natywnej konformacji i może wykonywać swoją funkcję ze 100 % wydajnością.
Jednym z najważniejszych wniosków tych badań było eksperymentalne wykazanie, że trójwymiarowa konformacja białka jest podawana przez jego podstawową strukturę.
W niektórych przypadkach proces denaturalizacji jest całkowicie nieodwracalny. Na przykład, kiedy gotujemy jajko, stosujemy ciepło w białkach (główny to albumina), które to stanowią, czysty ma solidny i białawy wygląd. Intuicyjnie może stwierdzić, że chociaż go ostygnie, nie powróci do swojej początkowej formy.
Może ci służyć: ovogeneza: fazy, cechy u zwierząt i roślinW większości przypadków procesu denaturalizacji towarzyszy utrata rozpuszczalności. Lepkość, prędkość dyfuzji jest również zmniejszona i łatwiej krystalizuje.
Białka opiekuńcze
Chaperonas lub białka chaperoniny są odpowiedzialne za zapobieganie denaturacji innych białek. Tłumią również niektóre interakcje, które nie są odpowiednie między białkami, aby zapewnić ich prawidłowe składanie.
Wraz ze wzrostem temperatury średniej białka te zwiększają ich stężenie i działają poprzez zapobieganie denaturacji innych białek. Właśnie dlatego nazywane są również „białkami wstrząsowymi” lub HSP ze względu na akronim w języku angielskim (Białka szoku cieplnego).
Chaperoniny są analogiczne do klatki lub lufy, która chroni białko interesujące w środku.
Te białka reagujące na sytuacje stresu komórkowego zostały zgłoszone w różnych grupach żywych organizmów i są wysoce zachowane. Istnieją różne rodzaje chaperonin i są klasyfikowane według ich masy cząsteczkowej.

