Związki organiczne

- 4011
- 137
- Filip Augustyn
Wyjaśniamy, jakie są związki organiczne, ich cechy, typy, różnice w związkach nieorganicznych i podajemy kilka przykładów
 Związki organiczne pochodzą z żywych istot
Związki organiczne pochodzą z żywych istot Jakie są związki organiczne?
Związki organiczne Są to te, które pochodzą z żywych istot i zawierające atomy węgla i wodoru połączone ze sobą w postaci otwartych łańcuchów lub zamkniętych cykli.
Oprócz węgla i wodoru, związki organiczne mogą również zawierać inne elementy, takie jak tlen (O), azot (N), siarka (s), fosfor (P), fluor (F), chlor (CL), brom (BR) lub jod (i). Wszystkie są nazywane heteroátomos.
Życie nie byłoby możliwe bez związków organicznych, więc wszystkie żywe istoty je zawierają. Istnieją tysiące tych substancji i możemy je znaleźć wszędzie, zaczynając od naszych własnych ciał.
Charakterystyka związków organicznych
Opierają się na chemii węgla
Węgiel stanowi podstawę wszystkich związków organicznych. W tych związkach atomy węgla można ze sobą powiązać lub z innymi pierwiastkami. Każdy atom węgla zawsze tworzy 4 wiązania, między prostymi, podwójnymi i potrójnymi wiązaniami.
Mają kowalencyjne linki
Istnieją trzy rodzaje głównych powiązań chemicznych, które są wiązaniem kowalencyjnym, jonowym i metalicznym. Związki organiczne charakteryzują się posiadaniem jedynie kowalencyjnych wiązań między wszystkimi ich atomami.
Są paliwami
 Węgiel jest paliwem uzyskiwanym ze związków organicznych obecnych w drewnie
Węgiel jest paliwem uzyskiwanym ze związków organicznych obecnych w drewnie Zawierając tak wiele atomów węgla, związki organiczne są palne. Oznacza to, że mogą płonąć za pomocą reakcji spalania z tlenem powietrza.
Reakcje spalania związków organicznych to reakcje egzotermiczne, które uwalniają bardzo ciepło. Wszystkie żywe istoty wykorzystują całą tę energię, aby wykonać wszystkie reakcje, które utrzymują nas przy życiu.
Mają izomerię
Wiele związków organicznych ma ten sam wzór molekularny, ale są to zupełnie inne związki. Ta właściwość nazywa się Isomeía i jest charakterystyczna dla związków organicznych.
Na przykład zarówno etanol metaliczny ma wzór molekularny C2H6Lub, ale pierwszy to gaz, a drugi to ciecz.
Mogą tworzyć polimery
Inną cechą związków organicznych jest to, że mogą tworzyć gigantyczne cząsteczki powtarzające grupę atomów w długim łańcuchu. Te związki nazywane są polimerami, a ich typowym przykładem są tworzywa sztuczne.
Rozpuszczalność
Inną właściwością, która charakteryzuje związki organiczne, jest ich rozpuszczalność. Wiele z nich, w szczególności polarne związki organiczne, jest rozpuszczalnych w wodzie. Inne związki nie rozpuszczają się w wodzie, ale w rozpuszczalnikach organicznych, takich jak cykloheksan.
Może ci służyć: kwas bursztynowy: struktura, właściwości, uzyskiwanie, zastosowaniaRodzaje związków organicznych
Związki organiczne mają właściwości i cechy, które bardzo różnią się od związków nieorganicznych (te, które nie pochodzą z żywych istot, takich jak minerały).
Wiele z tych cech pozwala im klasyfikować je na różne sposoby, co daje różne rodzaje związków organicznych. Najważniejsze kryteria klasyfikacji to:
- Zgodnie z jego pochodzeniem.
- Zgodnie z jego strukturą i składem.
- Według grupy funkcjonalnej.
- Według jego polaryzacji.
Następnie opisano rodzaje związków organicznych sklasyfikowanych zgodnie z każdym z tych kryteriów:
Rodzaje związków organicznych według ich pochodzenia
Jeśli pochodzą, związki organiczne mogą być:
- Naturalne związki organiczne: Są to znalezione w naturze i pochodzą bezpośrednio z żywych istot. Celuloza jest dobrym przykładem, ponieważ jest najliczniejszym naturalnym związkiem organicznym na Ziemi.
- Syntetyczne związki organiczne: Odnoszą się do tych związków organicznych, które są syntetyzowane przez chemikalia w laboratorium lub w elektrowni chemicznej. Wszystkie tworzywa sztuczne, których używamy codziennie, są syntetyczne, a także wiele leków.
Rodzaje związków organicznych według ich struktury i składu
Według atomów, które je zawierają i sposób, w jaki te atomy są razem zjednoczone, związki organiczne mogą być:
- Węglowodory alifatyczne: uformowane tylko przez węgiel i wodór i gdzie węglowodany tworzą otwarte łańcuchy albo liniowe lub rozgałęzione. Obejmują one alquenos i alkiny.
- Aromatyczne węglowodory: Związki należące do tej rodziny, zwane również piaskami, zawierają nienasycone cykle (które nadal mogą mieć więcej wodoru), które mają dużą stabilność molekularną. Ta właściwość nazywa się aromatycznością i jest charakterystyczna dla benzenu i wszystkich jej pochodnych.
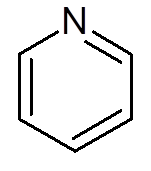
- Związki heterocykliczne: Są to związki cykliczne, w których jeden lub więcej atomów węgla zastępuje heteroátomo, który może być tlenem, azotem, siarką lub fosforem. Przykładami heterocykli są pirydyna i furano.
- Związki organometaliczne: Są specjalną klasą związków, które są w połowie drogi między byciem organicznym i nieorganicznym. Charakteryzują się zawieraniem części organicznej z heteroátomem.
Rodzaje związków organicznych zgodnie z grupą funkcjonalną
Część cząsteczki organicznej, w której zwykle występują reakcje chemiczne, jest niewielka grupa atomów zwanych grupą funkcjonalną. Istnieje kilka różnych grup funkcjonalnych, które umożliwiają klasyfikowanie związków organicznych w:
- Zamyka: Zawierają tylko węgiel i wodór połączone tylko przez proste wiązania. Na przykład Butan.
- Alkeny: Są węglowodorami zawierającymi podwójne wiązanie węglowe węglowe. Na przykład butenen.
- Alkynes: Są węglowodorami zawierającymi potrójne wiązanie węglowe. Na przykład Etino, znane również jako acetylen.
- Alkilowo -halogenomory: Związki organiczne zawierające halogen (F, Cl, Br lub I) powiązany z alifatycznym węglem. Na przykład chlorometan.
- Alkohole: Alkohole są polarnymi związkami organicznymi zawierającymi grupę hydroksylową (-OH) wraz z węglem alifatycznym.
- Fenole: Te związki zawierają również grupę hydroksylową (-OH), ale w tym przypadku wraz z aromatycznym węglem.
- ETHERY: Można je łatwo rozpoznać, ponieważ są dwa łańcuchy węgla razem ze sobą przez atom tlenu. Na przykład eter metylowy.
- Aminy: Są to związki organiczne pochodzące z amoniaku (NH3). Zawierają jeden lub więcej węgli alifatycznych (grupy alkilowe) powiązanych z atomem azotu za pomocą prostych wiązań.
- Aldehydes: Natlenione związki organiczne zawierające grupę karbonylową (C = O) wraz z wodorem w jednym z terminalnych węgli. Zasadniczo mają charakterystyczne zapachy, takie jak cyndehyd Cinamaldehyd, który daje zapach cynamonu.
- Ketony: Są to natlenione związki organiczne zawierające grupę karbonylową (C = O) wraz z dwoma łańcuchami węgla.
- Kwasy karboksylowe: Zwane także kwasami organicznymi, są to słabe kwasy zawierające grupę karboksylową (-COOH) w jednym z końcowych węgli.
- Estry: Pochodzą ze zjednoczenia kwasu karboksylowego z alkoholem. W takim przypadku wodór grupy karboksylowej zastępuje się grupą wynajmu.
- Amidas: Pochodzą ze zjednoczenia kwasu karboksylowego z aminą. W tym przypadku OH z grupy karboksylowej zastępuje się azotem przyłączonym do dwóch hydrogenów, wodoru i alkilu lub dwóch alkali.
Rodzaje związków organicznych według ich polaryzacji
Możemy również klasyfikować związki organiczne w polarnych i niepolarnych:
- Polarne związki organiczne: Związki te mają polarne wiązania kowalencyjne z atomami, takimi jak azot i tlen, które sprawiają, że cała polarna cząsteczka. Większość tych związków jest rozpuszczalna w wodzie.
- Niepolarne związki organiczne: To ci, którzy nie mają linków polarnych lub polaryzacje ich linków są anulowane. Te związki nie są rozpuszczalne w wodzie.
Różnice między związkami organicznymi i związkami nieorganicznymi
Poniższa tabela podsumowuje różnice między związkami organicznymi i nieorganicznymi:
Związki organiczne | Związki nieorganiczne | |
Pochodzenie: | Pochodzą z żywych istot lub ich szczątków. | Nie pochodzą z żywych istot. |
Kompozycja: | Utworzone prawie wyłącznie przez C, N, O, S, P, F, Cl, Br i I. | Mogą być utworzone przez dowolny element stolika okresowego. |
Rodzaje linków: | Tworzą kowalencyjne wiązania zarówno polarne, jak i apolarne. | Mogą tworzyć wszystkie rodzaje połączeń chemicznych, w tym polarne, apolarne, jonowe lub metaliczne wiązania kowalencyjne. |
Izomeria: | Większość obecnych Isomeía. | Tylko niektóre obecne Isomeía. |
Paliwa: | Są paliwami. | Większość nie jest palna. |
Przykłady związków organicznych
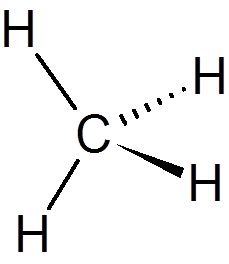
1. Metan (rozdz4)
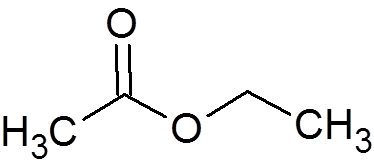
2. Octan etylu (c4H8ALBO2)
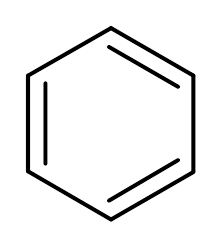
3. Benzen (c6H6)
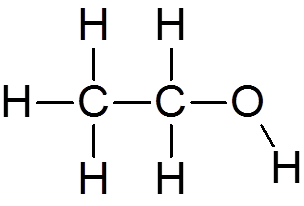
4. Alkohol etylowy (c2H6ALBO)
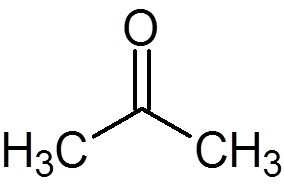
5. Aceton (c3H6ALBO)
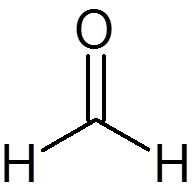
6. Formaldehyd (rozdz2ALBO)
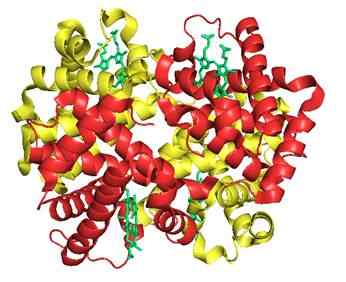
7. Hemoglobina (białko)
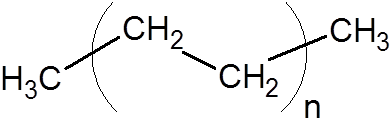
8. Polietylen (jeden z najczęstszych tworzyw sztucznych)
9. Glukoza (c6H12ALBO6)
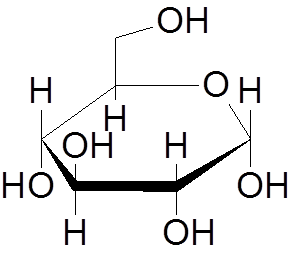
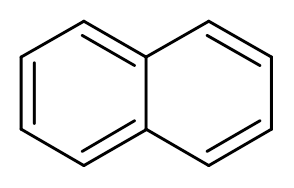
10. Naftalen (c10H8)
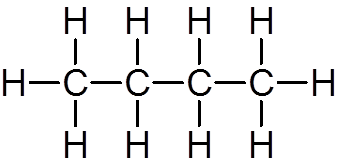
jedenaście. Butano (c4H10)
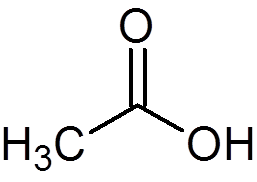
12. Kwas octowy lub ocet (c2H4ALBO2)
13. Neopentano (c5H12)
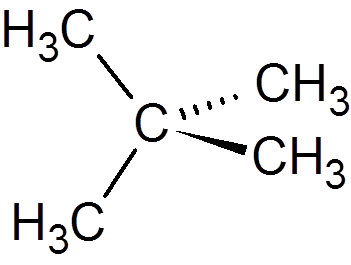
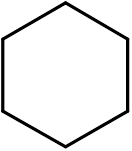
14. Cykloheksan (c6H12)
piętnaście. Pirydyna (c5H5N)
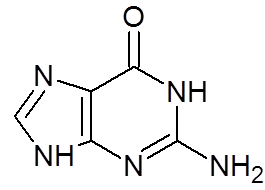
16. Guanina (c5H5N5ALBO)
17. Fruktoza (c6H12ALBO6)
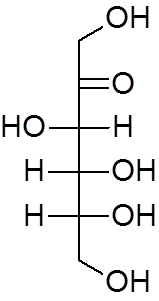
18. Eter etylowy (c4H10ALBO)
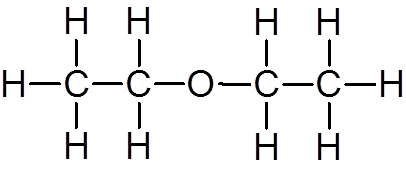
19. Metanol (rozdz4ALBO)
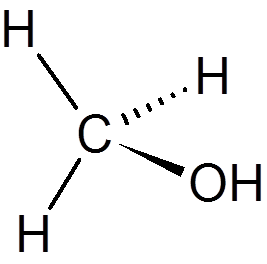
20. Chloroform (CHCl3)
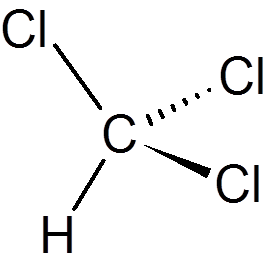
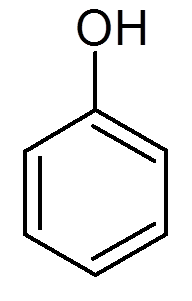
dwadzieścia jeden. Fenol (c6H6ALBO)
22. Acetylen (c2H2)
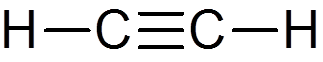
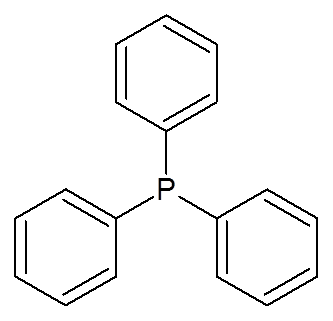
23. Trifenylofosfina (c6H6)3P)
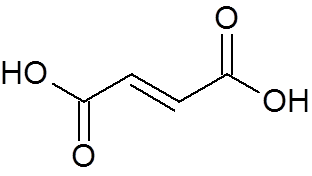
24. Kwas trans-guteodioesowy (c4H4ALBO4)
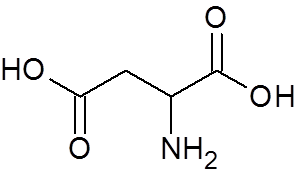
25. Kwas asparaginowy (aminokwas) (c4H7NIE4)
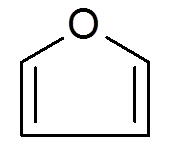
26. Furano (c4H4ALBO)
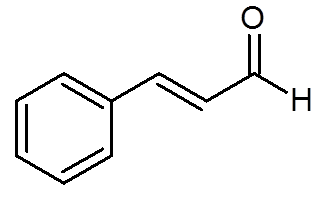
27. Cinamaldehyd (aromat cynamonu) (c9H8ALBO)
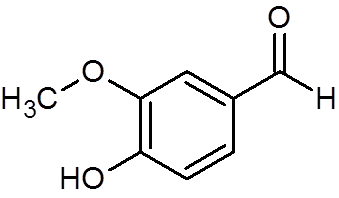
28. Vaniline (c8H8ALBO3)
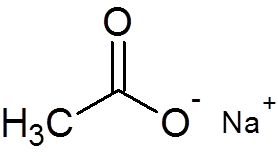
29. Octan sodu (c2H3ALBO2Na)
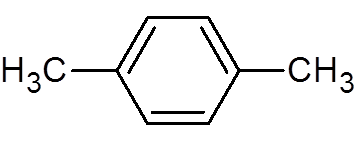
30. P-ksylen (c8H10)
Bibliografia
- Carey, f., & Giuliano, r. (2013). Chemia organiczna, wydanie 9 (9 wyd.). Nowy Jork, Nowy Jork: McGraw-Hill Education.
- Zamek a., M. G. (S.F.). Główne klasy związków organicznych i grup funkcjonalnych. Wyzdrowiał z ZEAEH.Edu.MX
- Chang, R., & Goldsby, k. DO. (2012). Chemia, 11. edycja (11 wyd.). Nowy Jork, Nowy Jork: McGraw-Hill Education.
- Klein, d. R. (2011). Chemia organiczna (1.Do wyd.). Hoboken, New Jersey: Wiley.
- Morrison, r. T., & Boyd, r. N. (2003). Chemia organiczna (6 wyd.). Boston, Massachusets: Allyn & Bacon.

