Związek chemiczny
- 4415
- 1217
- Marianna Czarnecki
Wyjaśniamy, z jakiego związków chemicznych składają się typy, różnice z pierwiastkami chemicznymi i podajemy kilka przykładów.
 Związki chemiczne to wszystko, co substancja, która ma atomy dwóch różnych pierwiastków chemicznych
Związki chemiczne to wszystko, co substancja, która ma atomy dwóch różnych pierwiastków chemicznych Co to jest związek chemiczny?
A związek chemiczny Jest to substancja utworzona przez połączenie dwóch lub więcej atomów różnych elementów chemicznych. Związki chemiczne pozostają zjednoczone dzięki wiązaniom chemicznym, które są związane z elektronami połączonych atomów; to znaczy w związku chemicznym (najbardziej zewnętrzne) elektrony atomów interweniują w tworzeniu linków.
Składników związków chemicznych (pierwiastków chemicznych) nie można oddzielić od siebie metodami fizycznymi, takimi jak: destylacja, wirowanie, filtracja itp., Wymaganie metod chemicznych, aby to osiągnąć.
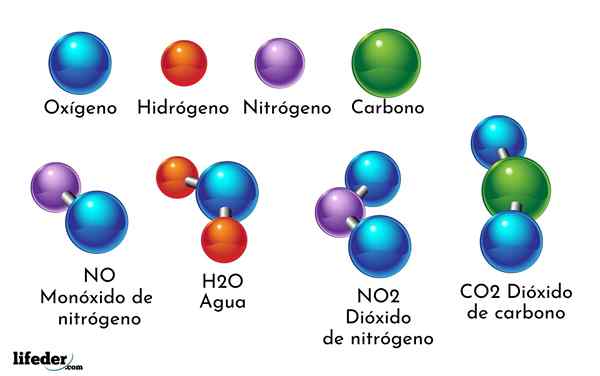
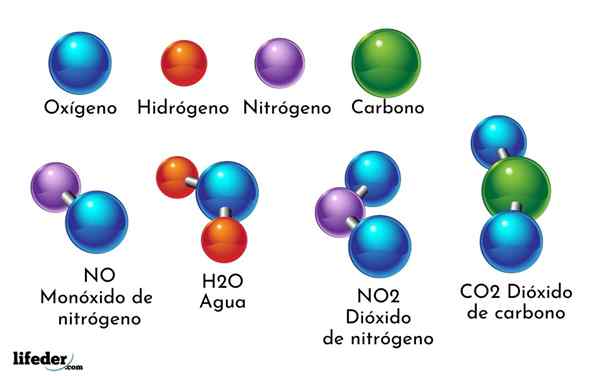
Przykładem związku chemicznego jest woda. Powstaje tylko dwa atomy dwóch różnych elementów chemicznych: tlen i wodór, o wzorze chemicznym H2ALBO. Dlatego dwa h wiążą się z jednym lub z tworzeniem h2ALBO.
Element chemiczny, w przeciwieństwie do związków chemicznych, jest najprostszym i najbardziej podstawowym sposobem, który stanowi materię. Jest przedstawiony jako unikalny rodzaj atomu, którego nie można podzielić na prostsze substancje za pomocą reakcji chemicznych.
Rodzaje związków chemicznych
Związki chemiczne można klasyfikować głównie po dwóch kryteriach:
- Zgodnie z rodzajem wiązania łączącego pierwiastki chemiczne obecne w związku chemicznym.
- Według składu i struktury związku chemicznego.
Według rodzaju linku
W zależności od rodzaju łącza związki chemiczne mogą być:
- Cząsteczki. Są to związki chemiczne utworzone przez dwa lub więcej rodzajów różnych elementów chemicznych, które łączy kowalencyjne wiązanie. Ten link charakteryzuje się dzieleniem jednej lub więcej par elektronów zewnętrznych lub walencji między dwoma atomami.
- Jony. Związki chemiczne obciążone elektrycznie nazywane są związkami chemicznymi jonowymi, a ich jony są zjednoczone przez Link jonowy. To wiązanie występuje podczas łączenia elementu chemicznego typu metalu z nie -metalowym elementem chemicznym.
- Związki międzymetaliczne. Jest to rodzaj stopu metalu, który stanowi stały materiał, który znajduje się między dwoma lub więcej metalowymi pierwiastkami chemicznymi, aby utrzymać je razem.
- Koordynacja. Są one tworzone przez centralny element metaliczny, zwany centrum koordynacji, i otaczają zestaw zjednoczonych cząsteczek lub jonów zwanych ligandami. Na przykład hemoglobina jest białkiem występującym w czerwonych krwinkach i transportuje tlen we krwi. Hemoglobina ma związek koordynacyjny o nazwie Grupo Hemo. Na środku hemo znajduje się atom żelaza, który interweniuje w transporcie tlenu przez hemoglobinę.
Według składu i struktury
Zgodnie z tym kryterium związki chemiczne są klasyfikowane jako organiczne i nieorganiczne.
- Związki organiczne. Są to związki, których głównym elementem chemicznym jest węgiel, który zwykle tworzy powiązania z atomami tego samego węgla i wodoru. Są jednak również obecne, choć w mniejszym stopniu, tlen, azot, siarka, bor, fosfor itp. Związki organiczne mogą być:
- Alifatyczny. Cząsteczki związków alifatycznych mogą mieć formy liniowe lub cykliczne, to znaczy w zamkniętych kształtach, takich jak trójkąty, kwadraty, pentagony itp. Mogą mieć wiązania węglowe trzech typów: proste (C-C), podwójne (C = C) lub potrójne (C≡C).
- Aromatyczny. Są to cykliczne związki, które na przemian przedstawiają proste wiązania węglowe i podwójne wiązania węglowe węglowe.
- Heterocykliczny. Są to związki o cyklicznej strukturze, które mogą przedstawić zastąpienie atomu węgla innym elementem chemicznym (O, S, N itp.).
- Organometalic. Są to związki organiczne, które mogą występować w swoich elementach metalowych składu.
- Polimery. Są to duże cząsteczki (makrocząsteczki), które są tworzone przez małe i identyczne jednostki, które są powtarzane w całym polimerze i nazywane monomerie.
- Związki nieorganiczne. Związki nieorganiczne, w przeciwieństwie do organicznych, nie mają węgla jako centralnego elementu chemicznego, ale raczej interweniują w ich składzie większość znanych elementów chemicznych. Związki nieorganiczne mogą być:
- Podstawowe tlenki. Powstają one przez reakcję metalu chemicznego, takiego jak sód, wapń, żelazo, miedź itp., Z tlenem. Na przykład tlenek sodu (NAO) jest podstawowym tlenek. Nazywa się je podstawowymi tlenkami, ponieważ dają powstanie podstaw lub wodorotlenków.
- Tlenki kwasowe. Pochodzą z reakcji niemetalicznego pierwiastka chemicznego, takiego jak chlor, fluor, siarka, brom itp., Z tlenem. Na przykład tlenek bromowy (BR2ALBO5) Jest to tlenek kwasu. Nazywane są tlenkami kwasu, ponieważ powodują one kwas.
- Hydrory. Prezentują w swoim składzie chemicznym obecność wodoru. Istnieją dwa typy: hydros metali i hydrory niemetaliczne.
- Metal. Powstają one przez reakcję wodoru ze stanem utleniania -1, z metalem. Te związki chemiczne są jedynymi, w których wodór występuje ze stanem utleniania -1. Na przykład cah2 Jest to wodorek wapnia.
- Nie metaliczny. Powstają one przez reakcję wodoru, ze stanem utleniania + 1, z elementem niemetalicznym o niższym stanie utleniania. Wodork chloru (HCl) jest gazem, który gdy kwas solony rozpuszcza się w wodzie.
- Kwasy. Są to nieorganiczne związki chemiczne, chociaż istnieją kwasy organiczne, które mają pH mniejsze niż 7 i zwracają się do koloru czerwonego papieru do czerwonego. Można je podzielić na hydracycydy i oksyk.
- Hydracy. Pochodzą z reakcji wodoru z nie -metalowym, tworząc wodorek, który rozpuszcza się w wodzie, pochodzi z kwasu; Na przykład kwas iarhydrryczny (HI).
- Oxcacids. Pochodzi z reakcji tlenku nie -metalowego elementu chemicznego z wodą. Na przykład reakcja tlenku siarkowego (więc3) Z wodą wytwarza kwas siarkowy (h2południowy zachód4).
- Ty wyjdź. Są to związki chemiczne, które pochodzą z interakcji kwasowych i podstawowych związków. W jego składzie może istnieć tyle elementów metalowych, co nie -metalowe. Sole są klasyfikowane jako:
- Sole neutralne. Pochodzą z reakcji neutralizacji między kwasem i zasadą o tworzeniu soli i wody. Na przykład reakcja wodorotlenku sodu (NaOH) z kwasem chlorowodorowym (HCL) wytwarza chlorek sodu (NaCl), sól i woda. Nazywa się je neutralnymi, ponieważ nie wytwarzają odmiany pH.
- Sole kwasowe. Powstają one przez reakcję wodorotlenku metalu z walencją +1, z kwasem z kilkoma hydrogenami. Reakcja wodorotlenku litu (LIOH) z kwasem węglowym (H (H2WSPÓŁ3), wytwarza zastąpienie tylko jednego wodoru litem, co powoduje wodorowęglan litu (Lihco3), Kwasowa sól i woda.
- Podstawowe sole. Są one wytwarzane przez reakcję zasady, która ma więcej niż jedną grupę OH z kwasem hydrazy, na przykład. Podczas reakcji kwasu z wodorotlenkiem wapnia, CA (OH)2, Atom chloru zastępuje grupę hydroksylową (OH). To wytwarza hydroksychlorek wapnia (cuckloh), podstawową sól i wodę.
Różnice między związkami chemicznymi a pierwiastkami chemicznymi
 W górę pierwiastków chemicznych i związków chemicznych. Związki chemiczne są tworzone przez powyższe pierwiastki
W górę pierwiastków chemicznych i związków chemicznych. Związki chemiczne są tworzone przez powyższe pierwiastki Każdy pierwiastek chemiczny odpowiada określonym atomowi i tylko z tego typem atomu; to znaczy, element chemiczny nie ma różnych rodzajów atomów. Atom jest elementarną cząstką materii, która nie jest podzielona metodami fizycznymi lub chemicznymi.
Atom pierwiastka chemicznego można połączyć z atomami innych elementów chemicznych w celu utworzenia związków chemicznych, które można podzielić na ich składniki (elementy chemiczne) przy użyciu metod chemicznych.
Można wyposażyć elementy chemiczne i związki chemiczne z układanką: elementy układanki mają różne cechy, dzięki czemu mogą pasować do pierwiastków chemicznych.
Puzzle mogą się przyłączyć, tworząc różne figurki. Utworzone liczby można utożsamiać ze związkami chemicznymi. Po zakończeniu aktywności figurki puzzli można podzielić na elementy, które.
Przykłady związków chemicznych
Poniżej możesz zobaczyć serię przykładów codziennych związków chemicznych:
- HCL: kwas chlorowodorowy
- H2S: Kwas sulfhydowy
- HF: kwas fluorowy
- H2południowy zachód4: Kwas Siarkowy
- Hclo4: Kwas nadchlorowy
- H3PO4: Kwas fosforowy
- H2WSPÓŁ3: Kwas węglowy
- Hno3: Kwas azotowy
- NaOH: wodorotlenek sodu
- CA (OH)2: Wodorotlenek wapnia
- Wiara (OH)2: Wodorotlenek żelaza
- Wiara (OH)3: Wodorotlenek żelazowy
- Nah: wodorek sodu
- Cu2O: Tlenek miedzi
- CUO: tlenek miedzi
- Wiara2ALBO3: Tlenek żelaza
- Cl2ALBO7: Tlenek nadchlorowodorów
- Br2O: Hipobromowy tlenek
- Siema2ALBO3: Tlenek hipooyodozowy
- NaCl: chlorek sodu
- Fecl3: Chlorek żelaza
- HCO3: Wodorowęglan sodu
- Ch3Ścieżka: octan sodu
- Na2południowy zachód4: Siarczan sodu
- Feso4: Siarcznik żelaza
- H2O: Woda
- WSPÓŁ2: Dwutlenek węgla
- C6H12ALBO6: Glukoza
- C12H22ALBOjedenaście: Sacharoza
Inne interesujące tematy
Reakcje chemiczne
Chemia w życiu codziennym: przykłady
Związki organiczne
Związki nieorganiczne
Wiązanie chemiczne
Czyste substancje
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2021). Związek chemiczny. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (27 sierpnia 2020). Definicja związku w chemii. Odzyskane z: Thoughtco.com
- TOPPR. (S.F.). Co jest złożone w chemii? Rodzaje związku chemicznego. Odzyskane z: toppr.com

