Chlorek wapnia (CACL2)
- 5096
- 481
- Prokul Woliński
Wyjaśniamy, jakie chlorek wapnia, jego struktura, właściwości fizyczne i chemiczne, jak jest syntetyzowany i jego zastosowania
Co to jest chlorek wapnia?
On chlorek wapnia (CACL2) Jest to sól nieorganiczna złożona z wapnia, metalu alkalicznego i chloru halogenowego. W tym związku istnieje kilka interakcji elektrostatycznych, które określają zewnętrzny wygląd ich kryształów i resztę jego właściwości fizycznych.
Towarzyszy mu również cząsteczki wody, tworząc hydraty ogólne COCL2· Xh2Lub, z x = 0, 1, 2, 4 i 6. Gdy x = 0, sól nie ma wody i jest bezwodna, na co wskazuje jej wzór chemiczny wspomniany powyżej.
Na lepszym obrazie zilustrowano niektóre stałe części CACL2. W warunkach niewielkiej wilgotności jest to możliwe.
Formuła
Jego formuła chemiczna to CACL2: Wyraża to dla każdego jonu2+ Istnieją dwa jony CL- które zneutralizują obciążenie dodatnie. Metal wapnia -grupa 2 stolika okresowego (SR. Scholambara)- daje swoje dwa elektrony do każdego atomu chloru, element grupy 17.
Struktura chlorku wapnia
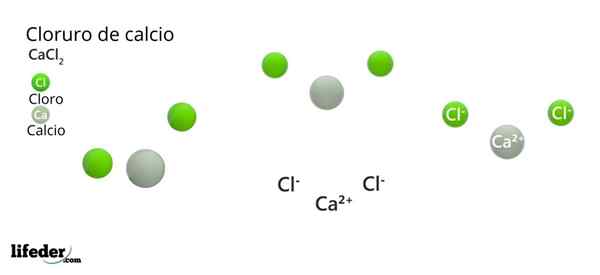
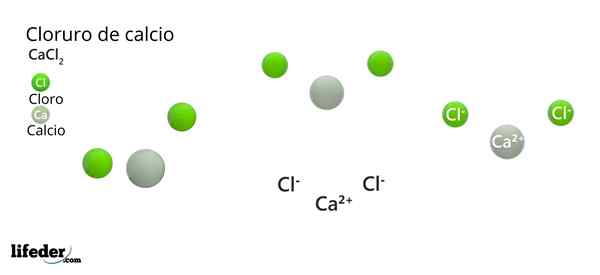
Na górnym obrazie zilustrowano strukturę CACL2 bezwodnik. Zielone kule odpowiadają jonom CL-, podczas gdy biały do jonów ca2+. Te kule są ustalane w równoległości, co jest niczym więcej niż jednolitą komórką ortorombową kryształów.
Struktura może podać fałszywą ideę, że wapń dominuje; Jeśli jednak odtworzono więcej powtórzeń komórki elementarnej, największa liczebność zielonych kul byłaby jasna: jony CL-.
Z drugiej strony jony CA2+ Mają mniejsze radia jonowe niż jony CL-. Wynika to z faktu, że gdy tracą elektrony, jądra atomów wywierają większą przyciągającą siłę na zewnętrzne warstwy elektroniczne, co zmniejsza promień jonowy.
W przypadku CL-, Ma to dodatkowy elektron, którego nie można przyciągnąć do tej samej siły, zwiększając w ten sposób jego promień jonowy.
Może ci służyć: roztwory wodneGeometria molekularna i wodne kompleksy wapnia
Na środku równoległości CA2+ Otoczony jest sześć CL-. Cztery z nich leżą w płaszczyźnie kwadratowej, a pozostałe dwa są zlokalizowane prostopadle (najbardziej odległe zielone kule w białej kuli).
W wyniku rozmieszczenia tych jonów, wokół CA2+ Octaedro to „broń”, przypisując w ten sposób oktaedryczną geometrię molekularną.
Biorąc pod uwagę, w jaki sposób ułożone są zielone kule, cząsteczka wody może zastąpić jedną z nich, która występuje udarem2· H2Lub prawdopodobnie w kwadratowej płaszczyźnie. Fakt ten modyfikuje strukturę krystaliczną, a gdy woda zastępuje zielone kule, układ jonów zmienia się bardziej.
Kiedy wszystkie jony CL- Są one zastępowane cząsteczkami wody, powstaje hydrat CACL2· 6H2ALBO. W tym momencie oktaedron jest „wodny”, a cząsteczki są teraz zdolne do interakcji między nimi przez mosty wodorowe (CA2+ Oh-H-oh2).
Kolejnie wapń może zaakceptować jeszcze więcej cząsteczek wody bez zmiany ustalonej proporcji. Oznacza to, że CACL2· 6H2Lub może przyjąć inne złożone struktury, do tego stopnia, że krystaliczne polimery wapnia i wody.
Jednak struktury te są mniej stabilne niż wzniesione przez interakcje elektrostatyczne (CA2+ i Cl-) z soli bezwodnikowej.
Używa/zastosowania chlorku wapnia
Główne zastosowania chlorku wapnia to:
- Unikaj zamarzania wody zimą. Chlorek wapnia wytwarza bardzo ciepło podczas rozpuszczania, a następnie, zwiększając temperaturę, występuje fuzja lodu. Z tego powodu jest wykorzystywany do zmniejszenia ryzyka krążenia ludzi i pojazdów podczas zimnej stacji.
- Pomóż kontrolować kurz na nieutwardzonych drogach.
- Przyspiesz prędkość suszenia betonu po wylaniu.
- Płyny Cachl2 Wzrasta wydajność wiercenia w celu ekstrakcji gazu z ich podziemnych złóż, a także ropa.
- Baseny są dodawane w celu zmniejszenia erozji cierpiącej przez beton jego ścian. Osad wapnia wypełnia tę funkcję.
- Ponieważ jest to sól higroskopijna, chlorek wapnia może być stosowany jako rozróżnienie, będąc w stanie obniżyć wilgoć otaczającego powietrza, a zatem z substancji w kontakcie z tym powietrzem.
- Jest stosowany jako konserwujący w niektórych produktach spożywczych, a także dodatkowy w kilku, takich jak napoje energetyczne używane przez sportowców, sery, piwa itp.
- W praktyce medycznej ma również użyteczność w leczeniu depresji spowodowanej przedawkowaniem siarczanu magnezu, a także w zatruciu ołowiem.
Synteza chlorku wapnia
Naturalnymi źródłami tego związku są salmueras wydobyty z mórz lub jezior.
Jednak jego główne źródło pochodzi z procesu Solvay, w którym wapień (CACO3) cierpieć szereg transformacji, aż wyprowadzono w chlorku wapnia według -produkt:
2nacl (aq) + caco3(s) na2WSPÓŁ3(s) + cacl2(AC)
Produktem zainteresowania tego procesu jest w rzeczywistości węglan sodu, na2WSPÓŁ3.
Właściwości chlorku wapnia
Właściwości fizyczne i przysmaki
To biała, toaleta i higroskopijna substancja stała. Ta tendencja do wchłaniania wilgoci w środowisku wynika z zasadowości jonów CA2+.
Zasadności jakiego rodzaju: Lewisa lub Bronsteda? Lewis, ponieważ gatunki dodatnie jest w stanie przyjmować elektron. Te elektrony są przekazywane na przykład przez atomy tlenu cząsteczek wody.
Stolizna wchłania wilgoć do stopnia rozpuszczania się w tej samej wodzie, która nakłada kryształy. Ta właściwość jest znana jako Delicuescencia.
Jego gęstość wynosi 2,15 g/ml. Gdy włącza wodę do swojej struktury, kryształ jest „rozszerzony”, zwiększając jego objętość, a zatem zmniejszając gęstość. Tylko CACL2· H2O Zerwaj z tym trendem, wykazując większą gęstość (2,24 g/ml).
Masa cząsteczkowa soli bezwodnej wynosi około 111 g/mol, a dla każdej cząsteczki wody w jej strukturze ta waga zwiększa 18 jednostek.
Rozpuszczalność
CACL2 Jest bardzo rozpuszczalny w wodzie i niektórych rozpuszczalnikach polarnych, takich jak etanol, kwas octowy, metanol i inne alkohole.
Ciepło ciepła
Gdy proces jest rozpuszczony w wodzie, jest egzotermiczny, a zatem podgrzewał roztwór i jego otoczenie.
Może ci służyć: skąd pochodzi plastik? Historia i typyJest tak, ponieważ kompleks wodny lepiej stabilizuje jony CA2+ w roztworze to interakcje elektrostatyczne z jonami CL-. Ponieważ produkt jest bardziej stabilny, stałe uwalnia energię w postaci ciepła.
Rozkład elektrolityczny
CACL2 stopione można poddać elektrolizy, proces fizyczny, który składa się z oddzielenia związku w jego pierwiastkach od działania prądu elektrycznego. W przypadku tej soli produkty to metaliczny wapń i chlor gazowy:
Cacl2(L) → Ca (S) + Cl2(G)
Jony ca2+ Są one zmniejszone w katodzie, a jony CL- Są utleniane na anodzie.
Bibliografia
- Wikipedia. (2018). Chlorek wapnia. Odzyskane z.Wikipedia.org
- Shiver & Atkins. (2008). Chemia nieorganiczna. W elementach grupy 2. (Czwarta edycja., P. 278). MC Graw Hill.
- Pubchem. (2018). Chlorek wapnia. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Oksychem. Chlorek wapnia: przewodnik po właściwościach fizycznych. Oxy wyzdrowiał.com
- Carole Ann. Powszechne zastosowania chlorku wapnia. Hunker wyzdrowiał.com