Historia chloru, właściwości, struktura, ryzyko, zastosowania

- 1545
- 261
- Bertrand Zawadzki
On chlor Jest to element chemiczny reprezentowany przez symbol CL. Jest to drugi z halogenów, znajdujący się poniżej fluoru, który jest również trzecim najbardziej elektroungatywnym elementem wszystkich. Jego nazwa pochodzi od żółtawego zielonego koloru, który jest bardziej intensywny niż fluorowa.
Popularnie, gdy ktoś słucha ich nazwy, co najpierw myśli, że jest w wybielaniu produktów do ubrań i w wodzie basenów. Chociaż chlor działa skutecznie w takich przykładach, nie jest to jego gaz, ale jego związki (szczególnie podchlorynowe), które wywierają działanie odchwytu i dezynfekujące.
 Okrągła kolba z gazowym chlorem w środku. Źródło: Larenmclan [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Okrągła kolba z gazowym chlorem w środku. Źródło: Larenmclan [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Na górnym obrazie pokazano okrągłą kolbę z chlorem gazowym. Jego gęstość jest większa niż w powietrzu, co wyjaśnia, dlaczego pozostaje w kolbie i nie ucieka w kierunku atmosfery; Jak w przypadku innych lżejszych gazów, powiedzieć hel lub azot. W tym stanie jest to wyjątkowo toksyczna substancja, ponieważ wytwarza kwas solny w płucach.
Dlatego chlor elementarny lub gazowy nie ma zbyt wielu zastosowań, więcej niż w pewnej syntezy. Jednak jego związki, soli, czy chlorowane cząsteczki organiczne, obejmują dobry repertuar zastosowań, umieszczający poza basenach i ubrania ekstremalnych białych.
Również jego atomy w postaci anionów chlorkowych znajdują się w naszych ciałach, regulujące poziomy sodu, wapnia i potasu, a także w soku żołądka. Jeśli nie, spożycie chlorku sodu byłoby jeszcze bardziej śmiertelne.
Chlor występuje poprzez elektrolizę solanki, bogatą w chlorek sodu, proces przemysłowy, w którym uzyskuje się również wodorotlenek sodu i wodoru. A ponieważ morza są prawie niewyczerpanym źródłem tej soli, potencjalne rezerwy tego elementu w hydrosfery są bardzo duże.
[TOC]
Historia
Pierwsze podejścia
Z powodu wysokiej reaktywności chloru, starożytne cywilizacje nigdy nie podejrzewały ich istnienia. Jednak ich związki były częścią kultury ludzkości z przeszłości; Jego historia zaczęła się powiązać ze wspólną solą.
Z drugiej strony chlor powstał z erupcji wulkanicznych i gdy ktoś rozpuścił złoto w wodzie królewskiej; Ale żadne z tych pierwszych podejść nie było wystarczające, aby sformułować pomysł, że ten żółtawy zielony gaz był elementem złożonym.
Odkrycie
Odkrycie chloru przypisuje się szwedzkiego chemika Carla Wilhelma Scheele, który w 1774 r. Wprowadził reakcję między pirolusitem mineralnym a kwasem solnym (wówczas zwanym kwasem muriatowym).
Scheele pozostaje z uznaniem, ponieważ był pierwszym naukowcem, który zbadał właściwości chloru; Chociaż został wcześniej rozpoznany (1630) przez Jana Baptist Van Helmont.
Eksperymenty, z którymi Scheele uzyskał swoje obserwacje, są interesujące: ocenił odbarwiające działanie chloru na czerwonawe i niebieskawe kwiaty kwiatów, a także w liściach roślin i owadów, które umarły natychmiast.
Powiadomił także swoją wysoką reaktywę na metale, jego duszący zapach i niepożądany wpływ na płuca, a kiedy rozpuścił się w wodzie, jego kwasowość wzrosła.
Kwas oimuriacyjny
Do tego czasu chemikalia uważały kwas dla wszystkich tych związków, które posiadały tlen; Więc brakowało im chloru. To było tak, że nazywali to „kwasem oksyuriatinowym” (tlenek kwasu muriatinowego), nazwa wymyślonego przez słynnego francuskiego chemika Antoine Lavoisier.
Następnie w 1809 roku Joseph Louis Gay-Lussac i Louis Jacques Thénard próbowali zmniejszyć ten kwas węglowy; reakcja uzyskana przez metale z ich tlenków. W ten sposób chcieli wyodrębnić element chemiczny z domniemanego kwasu ookymuryjskiego (który nazywali „deflistycznym powietrzem kwasu muriatowego”.
Jednak Gay-Lussac i Thénard nie udało się w swoich eksperymentach; ale odnieśli sukces, biorąc pod uwagę, że wspomniany żółtawy zielony gaz powinien być elementem chemicznym, a nie związkiem.
Rozpoznanie jako element
Rozpoznanie chloru jako elementu chemicznego było dzięki Sir Humphry Davy, który w 1810 r.
A ponadto to Davy wymyślił nazwę „chlor” dla tego elementu od greckiego słowa „chloros”, co oznacza żółtawo.
Gdy badali właściwości chemiczne chloru, stwierdzono, że wiele ich związków miało charakter soli fizjologicznej; Stąd nazwali go „halogenem”, co oznacza formator sprzedaży. Następnie zastosowano termin halogen z innymi elementami tej samej grupy (F, Br i I).
Michael Faraday udało się nawet upłynąć2· H2ALBO.
Może ci służyć: skuteczne obciążenie nuklearneReszta historii chloru jest powiązana z jego właściwościami dezynfekującymi i wybielającymi, z opracowaniem procesu przemysłowego elektrolizy solanki w celu uzyskania masywnych ilości chloru.
Fizyczne i chemiczne właściwości
Wygląd fizyczny
Jest to nieprzezroczysty żółtawy zielony gęsty gaz, irytujący zapach akra (super zintensyfikowana wersja komercyjnego chloru), a także jest wyjątkowo trująca.
Liczba atomowa (z)
17
Masa atomowa
35,45 u.
O ile nie wskazano inaczej, reszta właściwości odpowiada wielkościom mierzonym dla chloru molekularnego, Cl2.
Punkt wrzenia
-34,04 ºC
Temperatura topnienia
-101,5 ºC
Gęstość
-W normalnych warunkach 3,2 g/l
-Tuż w punkcie wrzenia, 15624 g/ml
Należy zauważyć, że ciekł chlor jest około pięć razy więcej niż jego gaz. Ponadto gęstość jej pary jest 2,49 razy większa niż powietrze. Dlatego na pierwszym zdjęciu chlor nie ma tendencji do ucieczki z okrągłej kolby, ponieważ jest gęstszy niż powietrze znajduje się w tle. Ta funkcja nadal stanowi bardziej niebezpieczny gaz.
Fusion Heat
6 406 kJ/mol
Ciepło parowe
20,41 kJ/mol
Molowa pojemność cieplna
33,95 J/(mol · k)
Rozpuszczalność wody
1,46 g/100 ml w 0 ° C
Ciśnienie pary
7,67 atm w temperaturze 25 ° C. Ciśnienie to jest stosunkowo niskie w porównaniu z ciśnieniem innych gazów.
Elektronialiczność
3.16 na skali Pauling.
Energie jonizacyjne
-Po pierwsze: 1251,2 kJ/mol
-Drugi: 2298 kJ/mol
-Po trzecie: 3822 kJ/mol
Przewodność cieplna
8,9 · 10-3 W/(m · k)
Izotopy
Chlor występuje w naturze przede wszystkim jako dwa izotopy: 35CL, z obfitością 76%i 37CL, z obfitością 24%. Zatem masa atomowa (35,45 u) jest średnią mas atomowych tych dwóch izotopów, z ich odpowiednimi odsetkami obfitości.
Wszystkie radioizotopy chloru są sztuczne, wśród których 36Cl jako najbardziej stabilny, z półfinansem wynoszącym 300 000 lat.
Liczby utleniania
Chlor może mieć kilka liczb lub stany utleniania, gdy jest częścią związku. Będąc jednym z najbardziej elektrowni atomów w tabeli okresowej, zwykle ma ujemne liczby utleniania; Z wyjątkiem sytuacji, gdy działa z tlenem lub fluorem, w których odpowiednio tlenki i fluorki muszą „stracić” elektrony.
W liczbach utleniania zakłada się istnienie lub obecność jonów o tej samej wielkości obciążenia. Tak więc mamy: -1 (cl-, Słynny anion chlorkowy), +1 (cl+), +2 (cl2+), +3 (cl3+), +4 (cl4+), +5 (cl5+), +6 (cl6+) i +7 (CL7+). Z wszystkich, -1, +1, +3, +5 i +7 są najczęstszymi znalezionymi w chlorowanych związkach.
Na przykład w CLF i CLF3 Liczby utleniania chloru wynoszą +1 (Cl+F-) i +3 (CL3+F3-). W CL2Lub to jest +1 (Cl2+ALBO2-); podczas gdy w Clo2, Cl2ALBO3 i Cl2ALBO7, Syn +4 (cl4+ALBO22-), +3 (cl23+ALBO32-) i +7 (CL27+ALBO72-).
Z drugiej strony we wszystkich chlorkach chlor ma liczbę utleniania -1; jak w przypadku NaCl (na+Cl-), Gdzie należy powiedzieć, że CL istnieje- Biorąc pod uwagę jonowy charakter tego soli.
Struktura elektroniczna i konfiguracja
Cząsteczka chloru
 Cząsteczka chloru dwuatomowa reprezentowana za pomocą modelu wypełnienia przestrzeni. Źródło: Benjah-BMM27 przez Wikipedia.
Cząsteczka chloru dwuatomowa reprezentowana za pomocą modelu wypełnienia przestrzeni. Źródło: Benjah-BMM27 przez Wikipedia. Atomy chloru w stanie podstawowym mają następującą konfigurację elektroniczną:
[Ne] 3s2 3p5
Dlatego każdy z nich ma siedem elektronów Walencji. O ile nie zostaną przeciążone energią, w przestrzeni będą indywidualne atomy, jakby były zielonymi kulkami. Jednak jego naturalną tendencją jest tworzenie kowalencyjnych więzi między nimi, aby ukończyć oktety Walencji.
Zauważ, że ledwo potrzebują elektronu, aby mieć osiem elektronów walencyjnych, więc tworzą jeden prosty link; To jest ten, który łączy dwa atomy Cl, aby stworzyć cząsteczkę CL2 (górny obraz), Cl-Cl. Dlatego chlor w normalnych i/lub naziemnych warunkach jest gazem molekularnym; nietonyatomia, jak ma to miejsce w przypadku gazów szlachetnych.
Interakcje międzycząsteczkowe
Molecula Cl2 Jest homonuklearny i apolowy, więc jego interakcje międzycząsteczkowe są rządzone przez siły dyspersji Londynu i jego masa molekularna. W fazie sody odległość Cl2-Cl2 Jest stosunkowo krótki w porównaniu z innymi gazami, które, dodając swoją masę, czyni go gazem trzy razy więcej niż powietrze.
Światło może wzbudzać i promować przejścia elektroniczne w molekularnych orbitalach CL2; W związku z tym pojawia się charakterystyczny żółtawy zielony kolor. Ten kolor nasila się w stanie ciekłym, a następnie częściowo znika, gdy zestala się.
Może ci służyć: słabe podstawyGdy temperatura opada (-34 ° C), cząsteczki CL2 Tracą energię kinetyczną i odległość Cl2-Cl2 zmniejsza się; Dlatego spójne i kończą definiowanie ciekłego chloru. To samo dzieje się, gdy system (-101 ° C) jest dalej chłodzony, teraz z cząsteczkami CL2 więc razem, które definiują kryształ ortorombowy.
Fakt, że istnieją kryształy chloru, wskazuje, że ich siły dyspersyjne są wystarczająco kierunkowe, aby stworzyć wzór strukturalny; To jest warstwy molekularne Cl2. Oddzielenie tych warstw jest takie, że nawet pod ciśnieniem 64 GPA jego struktura jest modyfikowana, ani nie wykazują przewodnictwa elektrycznego.
Gdzie to jest i uzyskaj
Sole chlorkowe
 Solidne kryształy Hality, lepiej znane jako wspólna lub sól stołowa. Źródło: Parent Géry [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Solidne kryształy Hality, lepiej znane jako wspólna lub sól stołowa. Źródło: Parent Géry [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Chloru w stanie gazowym nie można znaleźć nigdzie na powierzchni ziemi, ponieważ jest bardzo reaktywny i ma tendencję do tworzenia chlorków. Te chlorki są dobrze rozpowszechniane po skórce Ziemi, a ponadto po milionach lat przeciągania przez deszcze, morza i oceany wzbogacają.
Spośród wszystkich chlorków NaCl del Mineral Halita (obraz górny) jest najczęstszy i obfity; a następnie Silvina, KCl i Carnalita, MGCL Minerals2· Kcl · 6H2ALBO. Kiedy masy wody odparowują przez działanie słońca, pozostawiają pustynne jeziora solne, z których NaCl można ekstrahować bezpośrednio jako surowiec do chloru.
Elektroliza solanki
NaCl rozpuszcza się w wodzie w celu wytworzenia solanki (26%), do której elektroliza jest poddawana komórce chloralkalnej. Istnieją dwie reakcje półprzewodnikowe w przedziałach anodowych i katodowych:
2cl-(Ac) => cl2(g) + 2e- (Anoda)
2h2Lub (l) + 2e- => 2OH-(AC) + H2(g) (katoda)
A globalne równanie obu reakcji to:
2NACL (AC) + 2H2Lub (l) => 2naoh (ac) + h2(g) + cl2(G)
W miarę reakcji jony NA+ utworzone w anodzie, które migrują do przedziału katodowego, przekraczając przepuszczalną błonę azbestową. Z tego powodu NaOH znajduje się po prawej stronie równania globalnego. Oba gazy, CL2 i H2, Są zbierane odpowiednio z anody i katody.
Niższy obraz ilustruje nowy napis:
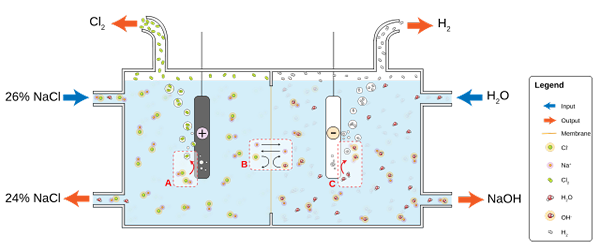 Schemat do produkcji chloru poprzez elektrolizę solanki. Źródło: Jkwchui [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Schemat do produkcji chloru poprzez elektrolizę solanki. Źródło: Jkwchui [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Zauważ, że stężenie solanki na końcu zmniejsza się o 2% (z 24 do 26%), co oznacza, że część jej Cl- Oryginały przekształcone w cząsteczki CL2. Ostatecznie uprzemysłowienie tego procesu przyznała metodę wytwarzania chloru, wodoru i wodorotlenku sodu.
Kwaśne rozpuszczanie pirolusitu
Jak wspomniano w sekcji historii, chlor gazowy może być wytwarzany przez rozpuszczenie próbek rudy pirolusytowej z kwasem solnym. Poniższe równanie chemiczne pokazuje produkty uzyskane z reakcji:
Mne2(s) + 4HCl (AC) => MCl2(AC) + 2H2Lub (l) + cl2(G)
Stopy
Nie ma stopów chloru z dwóch prostych powodów: ich cząsteczek gazowych nie można uwięzić między kryształami metali, a są one również bardzo reaktywne, więc reagowałyby natychmiast z metali, aby wytworzyć odpowiedni chlorek.
Z drugiej strony chlorki też nie są pożądane, ponieważ po rozpuszczeniu w wodzie wywierają efekt soli fizjologicznej, który promuje korozję w stopach; A zatem metale rozpuszczają się, tworząc chlorki metalowe. Proces korozji dla każdego stopu jest inny; Niektóre są bardziej podatne niż inne.
W związku z tym chlor nie jest dobrym dodatkiem dla stopów; ani jako cl2 ani jak Cl- (A atomy byłyby bardzo reaktywne, aby mogły nawet istnieć).
Ryzyko
Chociaż rozpuszczalność chloru w wodzie jest niska, wystarczy wytwarzać w wilgotności naszej skóry i oczu kwas solny, który kończy się na korozji tkanek powodujących poważne podrażnienia, a nawet utratę wzroku.
Jeszcze gorsze jest oddychanie żółtawych zielonkawych opar. Dzięki temu osoba doświadcza bólu gardła, kaszlu i oddychania z powodu płynów utworzonych w płucach.
Jeśli istnieje ucieczka chloru, jest on szczególnie niebezpieczna: powietrze nie może po prostu „zamiatać” oparów; Zostań tam, dopóki nie zareagują lub rozproszy się powoli.
Może Ci służyć: Precision Bilans: Charakterystyka, funkcje, części, zastosowaniaOprócz tego jest to związek wysoce utleniający, więc kilka substancji może reagować z nim wybuchowo na najmniejszy kontakt; Jak w przypadku wełny stalowej i aluminium. Dlatego tam, gdzie jest przechowywany chlor, należy podjąć wszystkie niezbędne rozważania, aby uniknąć ryzyka pożarowego.
Jak na ironię, podczas gdy chlor gazowy jest śmiertelny, jego anion chlorkowy nie jest toksyczny; Można go spożywać (z umiarem), nie spala ani nie reaguje, z wyjątkiem fluoru i innych odczynników.
Aplikacje
Synteza
Około 81 % chloru gazowego wytwarzanego co roku jest przeznaczone do syntezy chlorków organicznych i nieorganicznych. W zależności od stopnia kowalenowości tych związków chlor można znaleźć jako zwykłe atomy CL w chlorowanych cząsteczkach organicznych (z wiązaniami C-Cl) lub jako jony CL- W kilku soli chlorkowych (NaCl, CACL2, MGCL2, itp.).
Każdy z tych związków ma własne zastosowania. Na przykład chloroform (chcl3) i chlorek etylu (CH3Ch2Cl) są rozpuszczalnikiem, które były stosowane jako środki znieczulające inhalacyjne; Diclorometano (ch2Cl2) i tetrachlorku węgla (CCL4), Z ich strony, są rozpuszczalnikami szeroko stosowanymi w laboratoriach chemii organicznej.
Gdy te chlorowane związki są ciekłe, przez większość czasu są przeznaczone jako rozpuszczalniki dla reakcji organicznych.
W innych związkach obecność atomów chloru reprezentuje wzrost w momencie dipolowym, dzięki czemu mogą one oddziaływać w większym stopniu z matrycą polarną; A utworzone przez białka, aminokwasy, kwasy nukleinowe itp., Biomolekuły. Zatem chlor ma również papier w syntezie leków, pestycydów, środków owadobójczych, grzybobójców itp.
Jeśli chodzi o chlorki nieorganiczne, są one zwykle stosowane jako katalizatory, surowiec do uzyskiwania metali przez elektrolizę lub źródła jonów CL-.
Biologiczny
Gasowy lub elementarny chlor nie odgrywa żadnej roli w żywych istotach bardziej niż niszczenie ich tkanek. Nie oznacza to jednak, że ich atomów nie można znaleźć w ciele. Na przykład jony CL- Są bardzo obfite w pożywce komórkowej i zewnątrzkomórkowej i pomagają kontrolować poziomy jonów NA+ i CA2+, głównie.
Podobnie kwas solowy jest częścią soku żołądkowego, z którym pokarm jest trawiony w żołądku; jego jony CL-, W towarzystwie H3ALBO+, Zdefiniuj pH bliski 1 z tych wydzielin.
Broń chemiczna
Gęstość gazowego chloru sprawia, że jest to śmiertelna substancja, gdy jest rozlana lub wlana na zamknięte lub otwarte przestrzenie. Będąc gęstszym niż powietrze, jego prąd nie jest łatwo przeciąga chlor, więc pozostaje przez długi czas, zanim ostatecznie się rozproszy.
Na przykład w I wojnie światowej ten chlor był używany na polach bitewnych. Po zwolnieniu wkradł się do okopów, aby udusić żołnierzy i zmusić ich do wyjścia na powierzchnię.
Środek dezynfekujący
 Baseny są chloronizowane, aby uniknąć reprodukcji i rozprzestrzeniania się mikroorganizmów. Źródło: Pixabay.
Baseny są chloronizowane, aby uniknąć reprodukcji i rozprzestrzeniania się mikroorganizmów. Źródło: Pixabay. Roztwory chloronizowane, w których chlor gazowy został rozpuszczony w wodzie, a następnie alkalizowany za pomocą buforu, mają doskonałe właściwości dezynfekujące, a także hamować zgniliznę tkanek. Zastosowano je do dezynfekcji otwartych ran w celu wyeliminowania bakterii patogennych.
Woda basenowa jest dokładnie chloronizowana w celu wyeliminowania bakterii, drobnoustrojów i pasożytów, które mogą ją pomieścić. W tym celu używano chloru gazowego, jednak jego działanie jest dość agresywne. Zamiast tego stosuje się roztwory podchlorynowe sodu (wybielacz) lub kwas trichloroisocianurowy (ATC) (ATC).
Powyższe pokazuje, że to nie jest CL2 Ten, który wywiera działanie dezynfekujące, ale HCLO, kwas podchlorynowy, który wytwarza rodniki lub ·, które niszczą mikroorganizmy.
Wybielacz
Bardzo podobny do działania dezynfekującego, chlor również wybiela materiały, ponieważ kolory odpowiedzialne za HCLO. Zatem jego chloronizowane roztwory są idealne do usuwania plam z białych ubrań lub do pulpy papierowej wybielającej.
Chlorek winylu
Najważniejszym chlorowanym związkiem ze wszystkich, dla których przydzielono około 19% pozostałej produkcji chloru gazowego, jest polichlorowodorek winylowy (PVC). Ten plastik ma wiele zastosowań. Dzięki nim wykonane są rury wodne, ramy okien, ściany ścian i podłóg, okablowanie elektryczne, torby dożylne, płaszcze itp.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Chlor. Źródło: w:.Wikipedia.org
- Laura H. i in. (2018). Struktura chloru stałego przy 1.45 gpazeitschrift für kristallgraphie. Crystalline Materials, tom 234, wydanie 4, strony 277-280, ISSN (online) 2196-7105, ISSN (druk) 2194-4946, doi: doi.Org/10.1515/ZKRI-2018-2145
- National Center for Biotechnology Information. (2019). Chlor. Baza danych Pubchem. CID = 24526. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Marques Miguel. (S.F.). Chlor. Odzyskane z: Nautilus.Fis.UC.Pt
- American Chemistry Council. (2019). Chlor chloru: Wprowadzenie do chloru. Odzyskane z: chloru.Amerykalica.com
- Fong-yan ma. (S.F.). Korozowe wpływ chlorków na metale. Departament Inżynierii Morskiej, Republika Chin NTOU (Tajwan).
- Stan Nowy Jork. (2019). Fakty dotyczące chloru. Odzyskane z: zdrowie.NY.Gov
- Dr. Doug Stewart. (2019). Fakty elementów chloru. Chemicool. Odzyskane z: Chemicool.com

