Struktura chlorynu sodu (NaClo2), właściwości, zastosowania, ryzyko

- 4454
- 653
- Arkady Sawicki
On chlorek sodu Jest to nieorganiczna substancja stała utworzona przez jonowe sodowe na+ i chloryn jonowy2-. Jego formuła chemiczna to naclo2. Jest to krystaliczna biała stała, oprócz tego, że jest silnym środkiem utleniającym. Dlatego musi być bardzo ostrożny.
Jego głównym zastosowaniem jest jako środek dezynfekujący dla wielu aplikacji. Pozwala na wyeliminowanie drobnoustrojów na powierzchniach, takich jak podłogi, ściany i sprzęt laboratoryjny w szpitalach i klinikach oraz w ich systemach wodnych.
 Chloryn sodu naclo2 solidny. Autor: Chemicalinterest . Źródło: Wikimedia Commons.
Chloryn sodu naclo2 solidny. Autor: Chemicalinterest . Źródło: Wikimedia Commons. Również w placówkach rolniczych i weterynaryjnych, w celu higienicznej inkubatorów ptaków, w celu kontrolowania infekcji krów mlecznych, w celu dezynfekcji systemów wodnych dla zwierząt itp.
W przemyśle spożywczym ich zakwaszone roztwory wodne serwują do mycia mięsa, kurczaków, owoców, warzyw, a także sprzętu takich obiektów.
Z chlorynem sodu można przygotować dwutlenek chloru2 na miejscu użytkowania, który pozwala wyeliminować drobnoustroje, złe zapachy i smaki wody, aby była przyjemna i mogła pić bez problemów.
Służy również do wybielania miąższu papieru, między innymi oleju warzywnego i olejków.
Naclo2 Solidne musi być obsługiwane ostrożnie, ponieważ w kontakcie z niektórymi eksplozjami materiałów może wystąpić. Ich rozwiązania są nieco łatwiejsze do manipulowania, ale są bardzo utleniające i żrące.
[TOC]
Struktura
Chloryn sodu składa się z kationu sodu+ i anion chlorytowy2- Dlatego łączą się z więzi jonowa.
Anion chloryny ma atom chloru w stanie utleniania +3 i dwa atomy tlenu z walencją -2 każdy. Z tego powodu anion chloryny ma negatywny obciążenie.
Ma również konstrukcję w kształcie kąt.
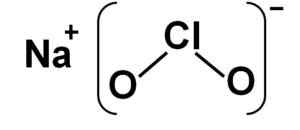 Struktura chlorynu sodu naclo2. Autor: Marilú Stea.
Struktura chlorynu sodu naclo2. Autor: Marilú Stea. Nomenklatura
- Chlorek sodu
- Chlorek sodu
- Sól sodu chloro
Nieruchomości
Stan fizyczny
Krystaliczna biała stała.
Waga molekularna
90,44 g/mol.
Temperatura topnienia
Rozkłada się, gdy topi się między 180 a 200 ° C.
Gęstość
2468 g/cm3
Rozpuszczalność
Rozpuszczalna woda: 64 g/100 g wody w 17 ° C. Lekko rozpuszczalne w metanolu.
Inne właściwości
Jest lekko higroskopowy.
Jest to silny środek utleniający. Reaguje gwałtownie z palnymi materiałami i redukcjami. Reaguje gwałtownie kwasami, generując chlor dwutlenku2.
Może ci służyć: Hume-Rotherty RulesJego roztwory alkaliczne (oznacza to, że w obecności na przykład NaOH) są dość stabilne, podczas gdy w kwaśnej pożywce powstaje HCLO kwasu chloro2, który szybko się rozkłada:
4 Hclo2 → 2 Clo2↑ + Clo3- + Cl- + 2 godz+ + H2ALBO
Ryzyko
Oba Naclo2 solidne, ponieważ ich wodne roztwory są potencjalnie niebezpieczne i wymagają dużej ostrożności i doświadczenia podczas ich manipulacji i przechowywania.
Naclo2 Solista może eksplodować podczas kontaktu z substancjami organicznymi, w tym rękawiczkami i odzieżą, materiałami do wycieków, takie jak bawełna tartaków i odpadów, a także oleje i tłuszcze.
Stała forma jest zatem bardzo trudna do transportu i preferowana jest użycie jej w postaci roztworów wodnych.
Te rozwiązania są wyjątkowo żrące. Powinny najlepiej zachować pH powyżej 8, to znaczy alkaliczne pH.
Naclo2 przyspiesza spalanie związków lub łatwopalnych materiałów, do tego stopnia, że może tworzyć z nimi wybuchowe mieszaniny.
W przypadku podgrzania emituj toksyczne dymy kwasu chlorowodorowego HCl i tlenku sodu na2ALBO. Jeśli jest przedłużony, aby ogrzewać lub strzelać, może to wykorzystać.
Uzyskanie
Przygotowuje się, że zaczyna się od chemicznej lub elektrochemicznej redukcji sodio naclo3, W obecności kwasu hydrochlorowego HCl do wytwarzania clo dwutlenku chloru2.
Ten ostatni reaguje z nadtlenkiem wodoru H2ALBO2 W wodnym roztworze wodorotlenku sodu NaOH i uzyskiwano roztwór chlorytu sodu sodu2, który odparowuje i krystalizuje ciało stałe.
Można go również uzyskać przez przepuszczanie gazu dwutlenku chloru2 Dla roztworu NaOH.
2 Clo2 + 2 naoh → naclo2 + Naclo3 + H2ALBO
Aplikacje
Jako mikrobobójcy i środki dezynfekujące w wielu zastosowaniach
Jest to składnik wielu produktów, które służą do kontrolowania bakterii, grzybów i szlamu lub mułu alga. Produkty, które go zawierają do tego celu, są wykorzystywane w rolnictwie, handlu, przemysłu i rezydencjach lub domach.
Służy jako dezynfekujący wielu rodzajów materiałów i powierzchni.
W rolnictwie drobi i podobne branże są dezynfekowane twarde powierzchnie, sprzęt, wyposażenie do inkubacji jaj ptaków, szklarni dla grzybów, takich jak grzyby oraz systemy wody chłodzącej i wody dla piórek ptaków.
Ma zastosowanie weterynaryjne jako miejscowego środka dezynfekującego w kontroli zapalenia sutka bydła mlecznego, aby zanurzyć sutki zwierzęcia. Zapalenie sutka jest infekcją wymiennych krów.
Może ci służyć: proces adiabatyczny: typy, przykłady, rozwiązywane ćwiczenia Czasami musisz zanurzyć krowy w roztworach chlorytów sodu, aby uniknąć w nich infekcji. Autor: Hans Braxmeier. Źródło: Pixabay.
Czasami musisz zanurzyć krowy w roztworach chlorytów sodu, aby uniknąć w nich infekcji. Autor: Hans Braxmeier. Źródło: Pixabay. Jest również wykorzystywany w naturalnych zakładach badawczych do odkażania laboratoriów.
Zastosowania komercyjne, przemysłowe i medyczne obejmują dezynfekowanie systemów wentylacji, twarde powierzchnie (takie jak podłogi, ściany, sprzęt laboratoryjny) i systemy wodne.
W placówkach opieki zdrowotnej, takich jak kliniki i szpitale, służy do odkażania pokoi, korytarzy, obszarów izolacji i sterylizacji materialnej.
Jest to również przydatne do higieny w placówkach, w których ludzie przechodzą leczenie zdrowotne w wodzie lub spa.
W branży spożywczej jest wykorzystywany jako fumigant do oszczędzania żywności.
Jest stosowany w postaci zakwaszonego chlorynu sodu. Jest to wytwarzane przez dodanie kwasu spożywczego (na przykład kwas cytrynowy, kwas fosforowy, kwas koła lub siarczan kwasu sodu) do wodnego roztworu chlorynu sodu.
Zakwaszony chloryn sodu ma właściwości przeciwdrobnoustrojowe i jest stosowany jako mycie rosy lub kurczaka lub roztwór moczowy, mięso, warzywa, owoce i produkty morskie. Również w wodzie, aby zamrozić kurczaka lub ptaki.
W gospodarstwach domowych pozwala dezynfekować twarde powierzchnie, takie jak podłogi i łazienki, systemy ogrzewania lub klimatyzacji oraz systemy krążenia wody w basenie.
 Aby dezynfekować baseny, możesz użyć chlorynu sodu naclo2. Autor: Age Global Group. Źródło: Pixabay.
Aby dezynfekować baseny, możesz użyć chlorynu sodu naclo2. Autor: Age Global Group. Źródło: Pixabay.  Produkty zawierające chlorynek sodu pozwalają na toalety łazienki. Autor: Michal Jarmoluk. Źródło: Pixabay.
Produkty zawierające chlorynek sodu pozwalają na toalety łazienki. Autor: Michal Jarmoluk. Źródło: Pixabay. Jest również sprzedawany w małych saszetkach wraz z innymi związkami w celu uwolnienia gazu i kontroli zapachów w domach.
Dezynfekować wodę pitną
Jest stosowany w oczyszczaniu wody do picia, działa jak utleniacz, poprawiając smak i zapach wody pitnej.
Chloryn sodu jest szeroko stosowany jako prekursor do wytwarzania dwutlenku chloru CLO2 który służy do leczenia wody pitnej w celu spożycia człowieka, to znaczy eliminować mikroorganizmy, zapachy i nieprzyjemne smaki i może pić.
Aby wygenerować CLO2 HCl można użyć:
5 Naclo2 + 4 HCl → 4 CLO2↑ + 5 NaCl + 2 H2ALBO
CLO2 Jest to środek przeciwdrobnoustrojowy utleniacza o wysokiej działaniu i szerokim spektrum. Oznacza to, że działa przeciwko dużej liczbie mikroorganizmów.
Może ci podawać: azotyn potasu (KNO2): struktura, właściwości i zastosowaniaMikroorganizmy są dezaktywowane, ponieważ CLO2 zakłóca ważne enzymy tych i białek błon komórkowych. Ma również tę zaletę, że nie wytwarza związków chlorowych, które są toksyczne.
Istnieją na sprzedaż tabletki chlorynu sodu zmieszane z innymi związkami, które są rozpuszczane w wodzie i natychmiast wytwarzają CLO2 w kontrolowany sposób, dezynfekując w ten sposób wodę.
 Chloryn sodu jest stosowany z innymi związkami w celu uzyskania wody pitnej gotowej do picia. Autor: Ulrike Leone. Źródło: Pixabay.
Chloryn sodu jest stosowany z innymi związkami w celu uzyskania wody pitnej gotowej do picia. Autor: Ulrike Leone. Źródło: Pixabay. Główny problem obróbki wody w celu usunięcia smaków i pachnie przez Clo2 Składa się z tego, że podczas leczenia można tworzyć toksyczne sole chlorytów i chloru.
Do opieki od obiektywu kontaktowego
Naclo2 Jest to element rozwiązań stosowanych do dezynfekcji soczewek kontaktowych.
Stosuje się kombinację NaClo2 i ślady (bardzo małe ilości) nadtlenku wodoru H2ALBO2.
H2ALBO2 Stabilizuj CLO2 To powstaje, a połączenie obu jest bardzo skuteczne przeciwko bakteriom, grzybom i drożdżom. Produkty, które są wówczas chlorek sodu, woda i tlen, które są nieszkodliwe, co oznacza, że nie są one szkodliwe dla oka.
Po usunięciu soczewek z roztworu, Naclo2 resztkowe rozkładają się szybko w Nall i o2. Resztkowy nadtlenek nie podrażnia oka. Dlatego rozwiązania te są bardzo bezpieczne.
 Rozwiązania dezynfekcji soczewek kontaktowych mają chlorynek sodu wśród ich składników. Autor: Nieuw ~ Commonswiki. Źródło: Wikimedia Commons.
Rozwiązania dezynfekcji soczewek kontaktowych mają chlorynek sodu wśród ich składników. Autor: Nieuw ~ Commonswiki. Źródło: Wikimedia Commons. W różnych aplikacjach
Chloryn sodu służy do przygotowania dwutlenku chloru2 do natychmiastowego zastosowania w dużej liczbie aplikacji, których niektóre były traktowane w poprzednich akapitach.
Służy do wybielania miąższu drewnianego, tekstyliów, takich jak bawełna, włókna roślinne, oleje jadalne i nieopisane, tłuszcze, lakiery, lakiery i woski.
Jest to składnik kropel do oczu i niektóre rozwiązania do doustnego mycia.
Jest stosowany w branży przetwarzania skóry oraz w agentach do elektrody metalowej (powłoka metalowa).
Bibliografia
- Williams, L. i in. (2019). Mikrobiologia, opieka i konserwacja obiektywu. W soczewkach kontaktowych (wydanie szóste). Odzyskane z naukowym.com.
- LUB.S. National Library of Medicine. (2019). Chlorek sodu. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Gray, n.F. (2014). Dwutlenek chloru. Proces technologii. W mikrobiologii chorób wodnych (wydanie drugie). Odzyskane z naukowym.com.
- McKen, L. (2012). Wprowadzenie do żywności i sterylizacji medycznej. Dwutlenek chloru. W przypadku sterylizacji na plastik i elastomery (wydanie trzecie). Odzyskane z naukowym.com.
- Ortenberg, e. i Telsch, B. (2003). Problemy ze smakiem i zapachem w wodzie pitnej. W podręczniku mikrobiologii wody i ścieków. Odzyskane z naukowym.com.
- Karsa, zm.R. (2007). Biocidy. Dwutlenek chloru. W Podręczniku do czyszczenia/odkażania powierzchni. Odzyskane z naukowym.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. VCH Verlagsgellschaft MBH.

