Enzym kinetyczny
- 3062
- 762
- Pani Gilbert Stolarczyk
Czym jest kinetyka enzymatyczna?
Enzym kinetyczny Jest to dziedzina badań, w której fizykochemia i biochemia spotykają się w celu zbadania reakcji chemicznych katalizowanych przez enzymy. Enzymy są katalizatorami biologicznymi, które zwiększają prędkość reakcji chemicznej poprzez zmniejszenie ich energii aktywacyjnej.
Enzymy katalizują reakcje chemiczne o ogromnym znaczeniu dla utrzymania życia. Mają zarówno pH, jak i optymalną temperaturę do wykonywania swojego katalitycznego działania na podłożu, więc są istotnymi czynnikami w badaniu ich działań.
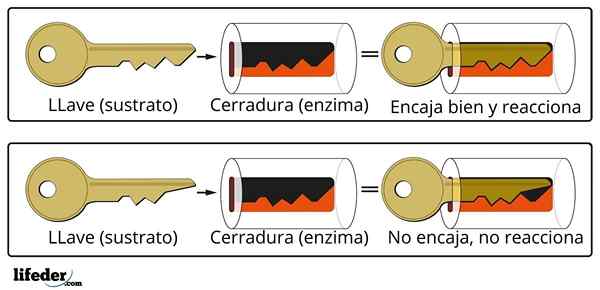
 System zamykania kluczy jest przybliżoną analogią do systemu enzymu podłoża.
System zamykania kluczy jest przybliżoną analogią do systemu enzymu podłoża. Enzym oddziałuje z substratem przez wyspecjalizowany region łańcucha białka, który nazywa się środkiem aktywnym, którego struktura trójwymiarowa jest sprzężona ze strukturą substratu. Interakcja między środkiem aktywnym a podłożem jest zwykle słaba i nie kowalencyjna.
Liczba aktywnych centrów enzymów jest ograniczona, co powoduje ich nasycenie za pomocą cząsteczek substratu, co z kolei zapobiega wzroście prędkości reakcji przekraczającej pewną wartość, znaną jako maksymalna prędkość.
Kinetyka enzymatyczna nie tylko łączy biochemię i fizykochemię, ale także bioinorganic, supramolekularną chemię, chemię obliczeniową i statystykę.
Wśród modeli, które go opisują, jest Michaelis -Menc. Dziś jest to jeden z modeli, które są najczęściej używane do opisania kinetyki enzymatycznej.
Podstawowe pojęcia w kinetyce enzymatycznej
Kataliza enzymatyczna
Enzymy są białkami o aktywności katalitycznej, zdolne do działania na cząsteczce zwanej substratem, katalizując jej transformację w inną substancję znaną jako produkt. Enzymy nie są spożywane podczas ich katalitycznego działania, pozostając stałą masą.
Aktywność katalityczna
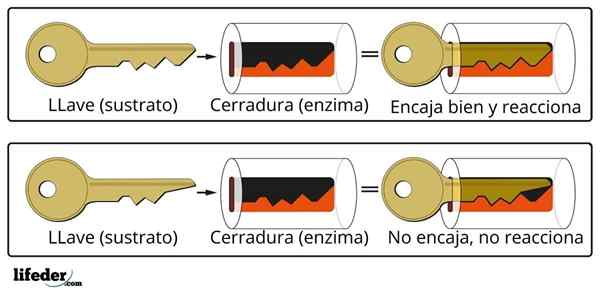
Aktywność katalityczna enzymu przeprowadzana jest w specjalistycznej trójwymiarowej strukturze znanej jako centrum aktywne. Wynika to z fałdu enzymatycznego łańcucha białkowego, który określa interakcję grupy aminokwasów, które tworzą aktywny środek.
Aktywne centrum
Aktywne centrum nie jest sztywną strukturą, ale zdolna do geometrycznego dostosowania się do podłoża do oddziaływania z nim. Interakcja jest ogólnie słaba (siły van der waals), chociaż istnieją enzymy, które tworzą kowalencyjne powiązanie z podłożem.
Może ci służyć: tłuszcz butyczny: pozyskiwanie, typy, skład, zastosowania, korzyściZmniejszona energia aktywacji
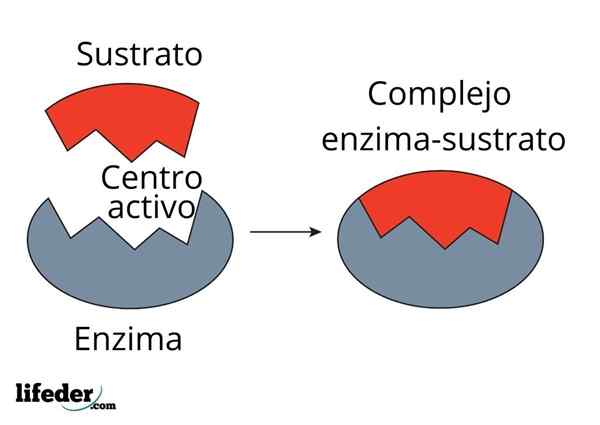
 Enzym anhydrazy węglowej zmniejsza energię aktywacji dla konwersji CO2 na H2CO3. Źródło: Fvasconcellos (Talk • Współpraca), CC BY-SA 3.0, Via Wikimedia Commons
Enzym anhydrazy węglowej zmniejsza energię aktywacji dla konwersji CO2 na H2CO3. Źródło: Fvasconcellos (Talk • Współpraca), CC BY-SA 3.0, Via Wikimedia Commons Enzymy katalizują reakcje zmniejszające energię aktywacji, a zatem również zmniejszając zużycie energii swobodnej (g) niezbędne do zakończenia katalizowanego procesu. Enzymy nie modyfikują punktu równowagi niekatalizowanych reakcji chemicznych.
Zwróć uwagę, w jaki sposób enzym anhydrazy karbonicznej zmniejsza energię aktywacji dla ko -konwersji2 do h2WSPÓŁ3. Chociaż odległość między czerwoną a niebieskawą linią nie wydaje się zbytnio, enzym ten zwiększa prędkość rzędu milionów razy (106), w porównaniu z reakcją przeprowadzoną bez ich uczestnictwa.
Stereoodspecyficzność
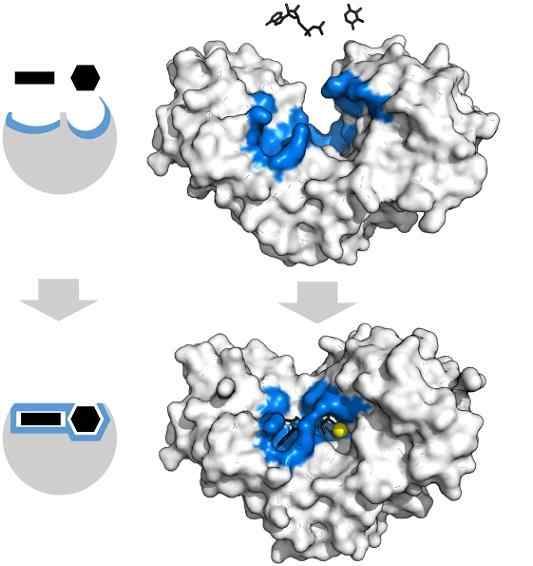 Tryfosforan i ksyloza adenozyny mają specyficzną postać, która pokrywa się z geometrią aktywnego środka enzymu heksochinazowego. Źródło: Thomas Shafee, CC przez 4.0, Via Wikimedia Commons
Tryfosforan i ksyloza adenozyny mają specyficzną postać, która pokrywa się z geometrią aktywnego środka enzymu heksochinazowego. Źródło: Thomas Shafee, CC przez 4.0, Via Wikimedia Commons Ogólnie enzymy są wysoce specyficzne dla reakcji, które katalizują, ponieważ cząsteczki substratu muszą oddziaływać z aktywnym centrum, które przedstawia zestaw wymagań dotyczących ich sprzężenia.
Zatem na przykład aktywne centrum heksochinazy, które jest dynamiczne ze względu na wibracje molekularne łańcuchów białkowych, oferuje grupy w dokładnych orientacjach przestrzennych, tak że cząsteczki adenozyny i ksylozy adenozyn.
Najmniejsze zaburzenia fizyczne lub chemiczne, a region niebieskiej -heksochinazy nie może już pomieścić substratów.
Maksymalna prędkość
Enzymy mają ograniczoną liczbę aktywnych centrów, więc poprzez zwiększenie stężenia substratu. To określa, że prędkość katalizowanej reakcji nie może wzrosnąć przekraczającego określoną wartość, znaną jako maksymalna prędkość.
Wrażliwość na temperaturę i pH
Aktywność katalityczna enzymatyczna zależy od temperatury i pH, mając optymalne wartości tych parametrów dla jej działania. Podobnie, ponieważ są to cząsteczki białka enzymów, są one podatne na denaturacja chemiczna lub termiczna.
Kofaktory
Niektóre enzymy zwiększają ich aktywność katalityczną ze względu na wpływ niektórych czynników, które mogą być metali lub związkami organicznymi znanymi jako koenzymy.
Podobnie enzymy można hamować konkurencyjnie i niekompetycznie. W przypadku heksochinazy z góry Mg2+ (żółta kula) działa jak kofaktor.
Szybkość reakcji enzymatycznej
Prędkość reakcji enzymatycznej zależy od stężenia substratu i stężenia enzymatycznego. Gdy stężenie substratu jest niskie, istnieje prawie liniowa zależność między prędkością enzymatyczną a stężeniem substratu.
Może ci służyć: bez metali: historia, właściwości, grupy, użyciaDlatego prędkość enzymatyczna wzrasta w bezpośrednim proporcji do stężenia substratu; Ale poprzez zwiększenie stężenia podłoża do wartości, która nasyca aktywne miejsca enzymu, maksymalna prędkość jest osiągana.
Gdy nastąpi prędkość enzymatyczna, staje się stała, to znaczy jest niezależna od stężenia podłoża i mówi się, że prędkość enzymatyczna wynosi zero. Ponadto katalityczna prędkość enzymatyczna jest proporcjonalna do stężenia kompleksu enzymu-substranowego [IS].
Jak pokazuje wyrażenie matematyczne:
V = k2[JEST]
Maksymalna prędkość jest wprost proporcjonalna do całkowitego stężenia enzymu, jak pojawia się w następującym wzorze:
VMax = KKotIT
KKot Jest to liczba obrotu lub wymiany i reprezentuje liczbę cząsteczek substratu, które każde miejsce enzymatyczne przekształca w produkt na jednostkę czasu. ChwilaT reprezentuje liczbę katalitycznych miejsc enzymatycznych. TakT Ma wysoką wartość, wymagane jest wyższe [s] do nasycenia aktywnych miejsc lub centrów.
Równanie Michaelis -cent
Model
Model Mihaelis -mente oparty jest na działaniu enzymów, które działają na prostym podłożu i nie ma zastosowania do enzymów alosterycznych; Oznacza to, że te, które mają region regulacyjny aktywności katalitycznej miejsca aktywnego.
Enzymy w niskim stężeniu substratu mają aktywność katalityczną, która jest liniowa ze stężeniem substratu; Ale przy wysokich stężeniach substratu aktywność katalityczna jest niezależna od stężenia substratu.
W 1913 r. Leonor Michelis i Maud Minded zaproponowali model wyjaśnienia wskazanego zachowania enzymatycznego, istnienie enzymatycznego kompleksu pośredniego [jest] ma znaczenie w modelu [IS].
Równanie ogólne
Związek tego kompleksu z innymi składnikami procesu enzymatycznego, a także ze stałymi (k), które je opowiadają, są wskazane w następującym schemacie:
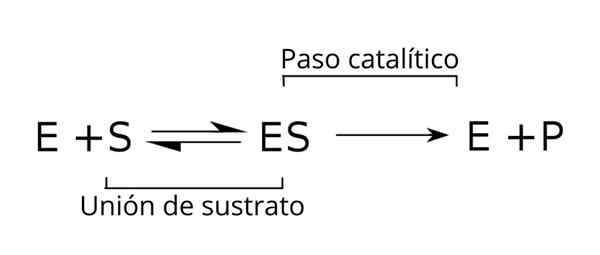 Ogólne równanie substratów, kompleks enzymu-substran i produkty kinetyki enzymatycznej. Źródło: Tim Vickers przez Wikipedia.
Ogólne równanie substratów, kompleks enzymu-substran i produkty kinetyki enzymatycznej. Źródło: Tim Vickers przez Wikipedia. Enzym (E) łączy się z substratem (-ów) w celu utworzenia kompleksu enzymu-substratu ze stałą prędkości K1. Kompleks E-S może dysocjować w E i S ze stałą prędkości reakcji k-1.
Podobnie kompleks może powodować produkt (P) i oddzielenie enzymu, które można poddać recyklingowi w celu spełnienia innego cyklu aktywności enzymatycznej. Sytuacja równowagi można osiągnąć dla stanu [IS], w którym jego prędkość tworzenia jest równa prędkości rozkładu.
Może ci służyć: naturalne pierwiastki chemiczneK1[IS] [s] = (k-1 + K2) [IS] (1)
Przegrupowanie warunków i wyczyszczenie [IS], masz:
[Is] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM Jest to stała wprowadzona przez Michaelisa.
Warunki równania Michaelis -cent
Zastępowanie teraz kM W (2) kontynuujemy:
[IS] = [e] [s] / kM (3)
Stężenie enzymu niekombinowego wynosi:
[E] = [eT] - [es] (4)
Gdzie [e] jest wolnym enzymem i [eT] Całkowite stężenie enzymu.
Łączenie równań 3 i 4, dokonywanie należnych substancji, a także biorąc pod uwagę vMax, Równanie Michaelisa-Muene jest osiągane, wyrażone w następujący sposób:
V = (vMax [S]) / ([s] + kM)
Maksymalna prędkość reakcji enzymatycznej występuje, gdy stężenie substratu jest znacznie większe niż kM A katalityczne miejsca enzymów są nasycone substratem. Dzieje się tak, gdy związek [s]/[s] + kM Podejścia do 1.
Kiedy [s] jest równe kM, Część równania [s] / [s] + kM jest równe 1/2, co wskazuje, że kM To stężenie substratu wytwarza enzymatyczną szybkość reakcji, która jest połowa maksymalnej prędkości.
Ponadto kM Jest to miara powinowactwa enzymu przez substrat: im większa wartość kM, nieletnie będzie powinowactwo enzymu do podłoża i odwrotnie. Dlatego do kM duża prędkość reakcji enzymatycznej będzie niska.
LineWeaver-Burk GHOVE
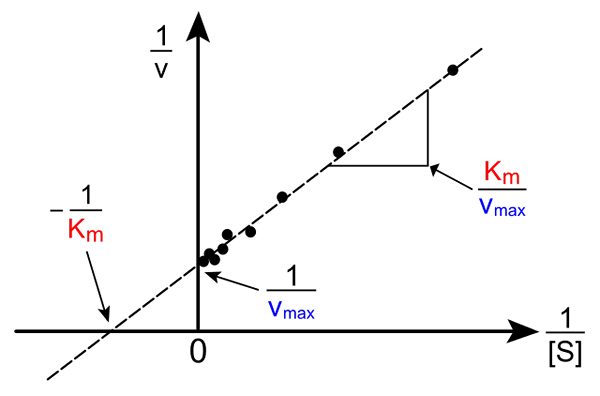 LineWeaver-Burk prosto. Źródło: Pro Bug Catcher Via Wikipedia.
LineWeaver-Burk prosto. Źródło: Pro Bug Catcher Via Wikipedia. Transformacja równania Michaelisa-Muene w celu wytworzenia jego odwrotnej postaci ma następującą formę:
1/v = (kM / VMax) (1 / [s]) + 1 / vMax
Znaczenie tej linii polega na tym, że ma ona skrzyżowanie z osą x w - 1/kM, i z osą y przy y = 1/vMax (obraz górny). Linia ma nachylenie kM/Vmax. To pozwala na informacje o vMax i kM wykresy odwrotności prędkości w zależności od odwrotności stężeń substratu.
Bibliografia
- Strayer, L. (1975). Biochemia. 2daje Wydanie. Redakcja Reverted.
- Iran. Levine. (2009). Zasady fizykochemii. Szósta edycja. MC Graw Hill.
- Wikipedia. (2020). Kinetyka enzymu. Źródło: w:.Wikipedia.org
- Michael Blaber. (5 czerwca 2019). Kinetyka enzymu. Biology Librettexts. Odzyskane z: bio.Librettexts.org
- Redaktorzy Enyclopaedia Britannica. (2020). Michaelis-Muen Kinetics. Odzyskane z: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biochemia. 5. edycja. Nowy Jork: W H Freeman; (2002). Sekcja 8.4: Model Michaelis odpowiada za właściwości kinetyczne wielu enzymów. Odzyskane z: NCBI.NLM.Nih.Gov

