Kwas hiposulfurowy
- 2368
- 566
- Eugenia Czapla
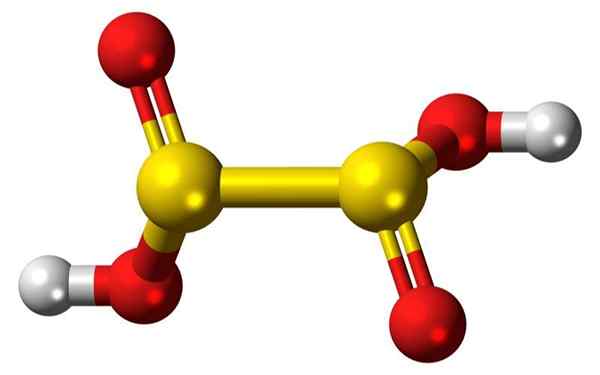
 3D prętów prętów i balonów z hiposulfurowej cząsteczki kwasu. Źródło: Jynto
3D prętów prętów i balonów z hiposulfurowej cząsteczki kwasu. Źródło: Jynto Co to jest hiposulfurowy kwas?
On Kwas hiposulfurowy, o kwas dioniczny, jest nieznany, niestabilny czysto, nie ma niezależnego istnienia i nie został wykryty w roztworze wodnym.
Teoretycznie byłby to stosunkowo słaby kwas, porównywalny z kwasem siarki, H2SO3. Znane są tylko ich sole, Dionitos, które są stabilne i są silnymi czynnikami redukującymi. Solą kwasu sodowego jest sodowa dionito.
Formuły
Formuły kwasu podskórne są następujące:
Kwas dioniczny: H2S2ALBO4
Dionito Anion: S2O42−
Sodum dionito: na2S2ALBO4
Numer CAS: 2019-46-7 kwas hiposulfuralny (lub Dital)
Numer CAS: 14844-07-6 Kwas hiposulfuralny (lub dition, jon)
Numer CAS: 7775-14-6 sodu Dionito (sód sodu kwasu ditoringowego)
Fizyczne i chemiczne właściwości
- W soli sodowej Dionito jego wygląd jest krystaliczny, biały do szarawego pyłu, z płatkami światła i słabego zielonego cytrynowego siarki.
- Masa cząsteczkowa kwasu ditowania wynosi 130.132 g/mol. Dionito Anion, 128.116 g/mol i sodowe Dionito, 174.096 g/mol.
- W temperaturze wrzenia sodu Dionito rozkłada się, a jego temperatura topnienia wynosi 52 ° C.
- Gęstość sodu Dionito wynosi 2.38 g/cm³ (bezwodny), a jego rozpuszczalność w wodzie wynosi 18.2 g/100 ml (bezwodny, 20 ° C).
- Kwas hiposulfuralny jest siarkowym okacidem o wzorze chemicznym H2S2ALBO4.
- Siarka oksoacidów to związki chemiczne zawierające siarkę, tlen i wodór. Jednak niektóre z nich są znane tylko ze swoich soli (takich jak kwas hiposulfurowy, kwas drzewny, kwas disiarczkowy i kwas siarki).
Może ci służyć: pirydyna: struktura, właściwości, zastosowania, toksyczność, syntezaWśród charakterystyk strukturalnych oksoacidów mamy:
- Siarka czworościenna po koordynowaniu z tlenem.
- Atomy tlenu w moście i zacisku.
- Grupy okresowe.
- S = S Terminale.
- Łańcuchy (-s-) n
Kwas siarkowy jest najbardziej znanym oksoacidem siarkowym.
- Anion Dionito (S2ALBO4] 2-) jest oksoanionem (jon z ogólnym wzorem axoy z-) siarki formalnie pochodzącej z kwasu ditirutowego.
- Jony Dionito doświadczają hydrolizy kwasowej i alkalicznej do tiosiarczanu i bibulfitu oraz siarczanu i siarczku.
- Solą kwasu sodowego jest dionit sodu (znany również jako hydrosulfit sodu).
- Można go uzyskać z bisulfitu sodu poprzez następującą reakcję:
2 Nahso3 + Zn → na2południowy zachód4 + Zn (OH) ²
Aplikacje
Jon dionitu jest często stosowany w połączeniu ze złożonym środkiem (na przykład kwas cytrynowy) w celu zmniejszenia oksydroksydu żelaza (III) w rozpuszczalnych związkach żelaza (II) i wyeliminowanie amorficznych faz mineralnych zawierających żelazo (III) w glebie (III) w glebie (III) w glebie (III) w glebie Analiza (ekstrakcja selektywna).
Dionito pozwala na zwiększenie rozpuszczalności żelaza. Dzięki silnemu powinowactwowi jonu Dionito do biwalentnych i trójwartościowych metalowych kationów, jest on używany jako środek chelatujący.
Rozkład Dionito wytwarza zmniejszone gatunki siarki, które mogą być bardzo agresywne w przypadku korozji stali i stali nierdzewnej.
Wśród zastosowań sodu Dionito mamy:
W przemyśle
- Ten związek jest solą rozpuszczalną w wodzie i może być stosowany jako środek redukujący w roztworach wodnych.
- Jest stosowany jako taki w niektórych procesach barwnika przemysłowego, głównie te, które obejmują barwniki siarki i barwniki wanny, w których barwnik nierozpuszczalny w wodzie można sprowadzić do soli z metalu alkalicznego o rozpuszczaniu wody (na przykład barwnik indygo).
Może ci służyć: kwasy: cechy i przykłady- Właściwości redukcji sodu Dionito eliminują również nadmiar barwnika, resztkowego tlenku i niechcianych pigmentów, poprawiając w ten sposób globalną jakość koloru.
- Sodu Dionito może być również stosowane do oczyszczania wody, oczyszczania gazu, czyszczenia i ekstrakcji. Może być również stosowany w procesach przemysłowych, takich jak środek sulfonowy lub źródło sodu.
- Oprócz przemysłu tekstylnego, ten związek jest używany w branżach związanych ze skóry, żywności, polimerach, fotografii i wielu innych. Jest również stosowany jako środek odbarwiający w reakcjach organicznych.
W naukach biologicznych
- Sodowe dionito jest często stosowane w eksperymentach fizjologii jako sposób na zmniejszenie potencjału redoks roztworów.
W naukach geologicznych
- Sodium Dionito jest często stosowane w eksperymentach chemii gleby w celu ustalenia ilości żelaza, które nie jest włączone do pierwotnych minerałów krzemianowych.
Bezpieczeństwo i ryzyko
Manipulowanie tym elementem należy wykonać w ekstremalnych warunkach. Jest wyjątkowo toksyczny i może reagować niebezpiecznie w połączeniu z wodą i powietrzem.
Następnie podkreślamy niektóre aspekty.
Reakcje powietrza i wody
- Dionito sodu to paliwo stałe, które rozkłada się powoli, gdy jest w kontakcie z wodą lub parą wodną, tworząc tiosiarczan.
- Ta reakcja wytwarza ciepło, które może dodatkowo przyspieszyć reakcję lub spowodować spalenie otaczających materiałów. Jeśli mieszanina jest ograniczona, reakcja rozkładu może powodować ciśnienie pojemnika, które można mocno złamać. Pozostając w powietrzu, utlenia się powoli, wytwarzając toksyczne gazy dwutlenku siarki.
Może ci służyć: nitrofurany: Charakterystyka, mechanizm działania i klasyfikacjaNiebezpieczeństwo ognia
- Sodowe dionito to łatwopalny i palny materiał. Może być zapalony kontaktem z mokrym powietrzem lub wilgocią. Możesz szybko spalić z efektem flara. Może reagować energicznie lub wybuchowo w kontakcie z wodą.
- Można rozbić wybuchowo po podgrzaniu lub bierze udział w ogniu. Może włączyć ponownie po wygaszeniu pożaru. Spływ może stworzyć niebezpieczeństwo ognia lub wybuchu. Kontenery mogą wybuchnąć po podgrzaniu.
Niebezpieczeństwo zdrowotne
- Po kontakcie z ogniem Dionito sodu wytwarza irytujące, żrące i/lub toksyczne gazy. Wdychanie produktów rozkładowych może powodować poważne obrażenia lub śmierć. Kontakt z substancją może powodować poważne oparzenia na skórze i oczu. Spływ kontroli pożaru może spowodować zanieczyszczenie.
Bibliografia
- Benjah-BMM27 (2006). Model jonu ditionitu ditionitu [obraz] z piłki.Wikipedia.org.
- Mills, ur. (2009). Sodu-dithionitu -xtal-1992-3d-balls [obraz] odzyskane z: w: w.Wikipedia.org.

