Kwas fosforowy (H3PO3)
- 2390
- 736
- Paweł Malinowski
 Struktura chemiczna kwasu fosforu. Z licencją
Struktura chemiczna kwasu fosforu. Z licencją Co to jest kwas fosforowy?
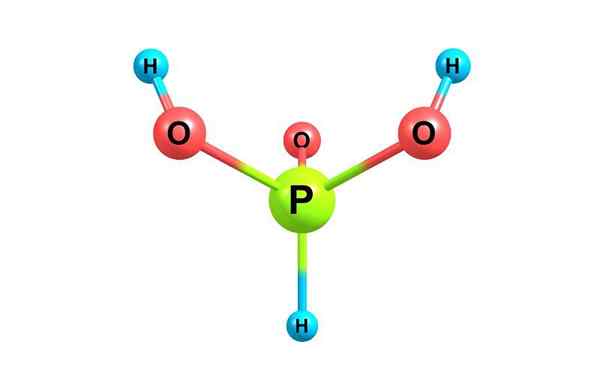
On kwas fosforu, Nazywany również kwasem ortofosforującym, jest to chemiczny związek o wzorze H3PO3. Jest to jeden z różnych utlenianych kwasów fosforu, a jego struktura jest prezentowana na górnym obrazie.
Biorąc pod uwagę wzór złożony, można to przepisać jako HPO (OH)2. Gatunek ten istnieje w równowadze z niewielkim tautomerem P (OH)3.
Zalecenia IUPAC, 2005, to to, że ten ostatni nazywa się kwasem fosforowym, podczas gdy postać dihydroksy nazywana jest kwasem fosfonicznym. Tylko związki zmniejszone fosfor to zaklęcia z zakończeniem „niedźwiedziem”.
Kwas fosforowy jest kwasem dioprotycznym, oznacza to, że ma on tylko zdolność do uzyskania dwóch protonów. Dzieje się tak, ponieważ większość tautomer jest h3PO3.
Gdy ta forma traci proton, rezonans stabilizuje utworzone aniony. P (OH) Tautomero 3 nie ma korzyści ze stabilizacji rezonansu. To znacznie utrudnia eliminację trzeciego protonu.
Kwas fosforowy (h3PO3) Sprzedaż zwana fosforami, które są stosowane jako środki redukujące. Przygotowuje się go przez rozpuszczenie heksosku tetrafosforowego (str4ALBO6) Według równania:
P4ALBO6 + 6 H₂O → 4 HPO (OH)2
Czysty kwas fosforu, H3PO3, Lepiej przygotowuje się go przez hydrolizę fosforu, PCL3.
PCL3 + 3H2O → HPO (OH)2 + 3HCl
Powstały roztwór jest podgrzewany w celu wydalenia HCl, a pozostała woda odparowuje, aż się pojawi 3PO3 krystaliczne kolorowe podczas chłodzenia. Kwas można również uzyskać przez działanie wody na PBR3 lub pi3.
Właściwości fizyczne i chemiczne kwas fosforu
- Kwas fosforowy to biały lub żółty higroskopowy kryształ czworościenny, z aromatem podobnym do czosnku.
Może ci służyć: nienasycone rozwiązanie- H3PO3 Ma masę cząsteczkową 82,0 g/mol i gęstość 1651 g/ml.
- Związek ma temperaturę topnienia 73 ° C i rozkłada się powyżej 200 ° C.
- Jest rozpuszczalny w wodzie, jest w stanie rozpuścić 310 gramów na 100 ml tego rozpuszczalnika. Jest również rozpuszczalny w etanolu.
- Jest to silny kwas z PKA między 1,3 a 1,6.
- Ogrzewanie kwas fosforu w około 200 ° C sprawia, że jest on dysproporcja na kwasie fosforowym i fosfinie (pH3). Fosfina to gaz, który zwykle włącza się spontanicznie w powietrzu.
4h3PO3 + Ciepło → Ph3 + 3H3PO4
Reaktywność i niebezpieczeństwa
Reaktywność
- Kwas fosforu nie jest stabilnym związkiem.
- Wchłaniaj tlen powietrza, tworząc kwas fosforowy.
- Uformuj żółte osady w roztworze wodnym, które są spontanicznie łatwopalne podczas suszenia.
- Reaguj egzotermicznie z zasadami chemicznymi (na przykład: aminy nieorganiczne i wodorotlenki), aby utworzyć sole.
- Reakcje te mogą generować niebezpiecznie duże ilości ciepła w małych przestrzeniach.
- Rozpuszczanie wody lub rozcieńczenie stężonego roztworu z dodatkową wodą może wytwarzać znaczne ciepło.
- Reaguje w obecności wilgotności z metali aktywnych, w tym metali strukturalnych, takich jak aluminium i żelazo, w celu uwolnienia wodoru, łatwopalnego gazu.
- Możesz rozpocząć polimeryzację niektórych alkenów. Reaguje ze związkami cyjankowymi w celu uwalniania gazowego wodoru cyjanku.
- Może generować łatwopalne i / lub toksyczne gazy w kontakcie z ditiokarbamatami, izocianatami, kupcami, azotkami, nitlilami, siarczkami i silnymi środkami redukującymi.
- Dodatkowe reakcje generowania gazu są wytwarzane za pomocą siarków, azotynów, tiosiarczanów (w celu podania H2 i SO3), Dionitos (w celu podania SO2) i węglanów (w celu podania Co₂).
Może ci służyć: einstenio (y): struktura, właściwości, uzyskiwanie, użyciaNiebezpieczeństwa
- Związek jest żrący dla oczu i skóry.
- Kontakt wzrokowy może spowodować uszkodzenie rogówki lub ślepotę.
- Kontakt ze skórą może powodować zapalenie i pęcherze.
- Wdychanie pyłu spowoduje podrażnienie przewodu pokarmowego lub oddechowego, charakteryzującego się spalaniem, kichaniem i kaszlem.
- Poważne nadmierne ekspozycje może powodować uszkodzenie płuc, uduszenie, utrata wiedzy lub śmierć.
Działanie w przypadku szkód
- Upewnij się, że personel medyczny jest świadomy zaangażowanych materiałów i podejmuje środki ostrożności w celu ochrony siebie.
- Ofiara musi zostać przeniesiona na świeżą stronę i zadzwonić do ratownictwa medycznego.
- Sztuczne oddychanie należy podać, jeśli ofiara nie oddycha.
- Metodę ust do ust nie należy stosować, jeśli ofiara spożyła lub wdychała substancję.
- Sztuczne oddychanie wykonuje się za pomocą maski kieszonkowej wyposażonej w jednokierunkową zawór lub inne odpowiednie urządzenie oddechowe.
- Tlen należy podawać, jeśli oddychanie jest trudne.
- Zanieczyszczone ubrania i buty muszą być usuwane i odizolowane.
- W przypadku kontaktu z substancją spłucz skórę lub oczy natychmiast za pomocą bieżącej wody przez co najmniej 20 minut.
- W przypadku niższego kontaktu skóry materiału należy unikać na skórze niezbędnej.
- Utrzymuj ofiarę spokój i gorąco.
- Wpływ narażenia (inhalacja, spożycie lub kontakt skóry) można opóźnić.
Zastosowania kwas fosforu
- Najważniejszym zastosowaniem kwasu fosforu jest wytwarzanie fosfortów stosowanych w uzdatnianiu wody. Kwas fosforowy jest również stosowany do przygotowania soli fosforycznych, takich jak fosforyt potasowy.
Może ci służyć: Boyle Law- Fosforyty wykazały skuteczność w kontroli różnych roślin.
- W szczególności leczenie przez wstrzyknięcie tułowia lub liści, które zawiera fosforowe sole kwasowe, jest wskazane w odpowiedzi na infekcje z powodu patogenów roślinnych phytoftera i typu Pythium (wytworzyć rozkład korzenia).
- Kwas fosforu i fosfory są stosowane jako środki redukujące w analizie chemicznej. Nowa wygodna i skalowalna synteza kwasów fenylooctowych, poprzez redukcję katalizowaną przez jodek kwasu mandelicznego, opiera. W tym celu kwas fosforowy stosuje się jako reduktor stechiometryczny.
- Jest stosowany jako składnik produkcji dodatków stosowanych w przemyśle Poli (chlorek winylu). Również estry kwasu fosforu są stosowane w kilku reakcjach syntezy organicznej.
Bibliografia
- Kwas fosforowy (H3PO3). Odzyskane z Britannica.com.
- Kwas mushonowy. Odzyskane z EBI.AC.Wielka Brytania.

