Synteza kwasu fenoksyoctowego, procedura, stosowanie, ryzyko
- 1890
- 528
- Pani Waleria Marek
On Kwas fenoksyoctowy Jest to substancja organiczna, utworzona przez reakcję między fenolem a kwasem monochlorooctowym w obecności roztworu wodorotlenku sodu. Procedura zastosowana do uzyskania tego produktu nazywa się syntezą eterów Williamsona.
Zsyntetyzowany kwas fenoksyoctowy jest białym lub bezbarwnym osadem, utworzonym przez kryształy w kształcie igły, praktycznie nierozpuszczalne w wodzie (rozpuszczalność w wodzie 12 g/l l-1), Ale rozpuszczalny w kwasie octowym, fenolu i eterze dietestrowym.
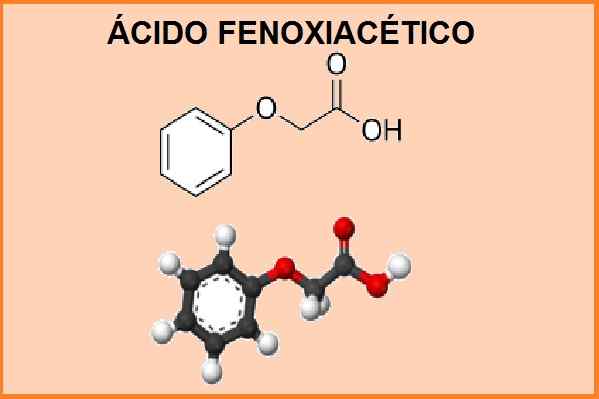
 Struktura chemiczna kwasu fenoksyoctowego. Źródło: „Kwas fenoksyoctowy”. Wikipedia, bezpłatna encyklopedia. 13 maja 2014, 17:21 UTC. 13 maja 2014, 17:21 w.Wikipedia.org. Edytowany projekt obrazu.
Struktura chemiczna kwasu fenoksyoctowego. Źródło: „Kwas fenoksyoctowy”. Wikipedia, bezpłatna encyklopedia. 13 maja 2014, 17:21 UTC. 13 maja 2014, 17:21 w.Wikipedia.org. Edytowany projekt obrazu. Jego chemiczna nazwa to 2-fenoksyetanoiczna, a jego wzór molekularny to C8 H8 ALBO3. Masa cząsteczkowa wynosi 152,15 g.mol-1. Ten produkt zachowuje się jak słaby kwas i ma temperaturę topnienia między 98 a 100 ° C i temperaturę wrzenia 285 ° C.
Kwas fenoksyoctowy jest produktem pośredniego w syntezie substancji z właściwościami herbicydu. Sam w sobie kwas fenoksyoctowy ma właściwości przeciwgrzybicze przed Candida albicans i Trichophyton Rubrum. Jest również przydatny jako złuszczający skórę, eliminując nadmiar keratyny w modzeli.
Konieczne jest posiadanie środków ostrożności w zakresie obsługi, ponieważ gdy podgrzewane emituje toksyczne gazy, które są żrące. Wśród gazów jest chlorek wodoru.
Bezpośrednia ekspozycja z tym produktem może powodować łagodne podrażnienie skóry lub śluzowe, chociaż nie ma dużego znaczenia, z wyjątkiem wpływu błony śluzowej oka, może być poważne. Powoduje również podrażnienie dróg oddechowych, jeśli jest on wdychany i szlaku żołądka, jeśli jest spożywany.
Jest to subtelna i dość stabilna substancja w temperaturze pokojowej, jednak w wysokich temperaturach lub ciśnieniach może stracić swoją stabilność, a w obliczu wody może zwolnić pewną ilość energii, ale nie zrobi tego gwałtownie.
[TOC]
Synteza kwasu fenoksyoctowego
Fenol jest alkoholem i jako taki zachowuje się jak słaby kwas, dlatego łatwo traci kwas (H. H+) Przed alkaliami (wodorotlenek sodu), aby stać się alkoleniem (fenolanem). To później, poprzez bimolekularne podstawienie nukleofilowe, utworzy eter.
Może ci służyć: tlenek boru (B2O3): co to jest, struktura, właściwości, użyciaAlcoxide działa jako nukleofil, to znaczy jest w stanie zrezygnować z 2 elektronów, które są wolne od innej substancji. W przypadku reakcji pod ręką jest to alkilowy halogened (kwas monochlorooctowy), w taki sposób, że silnie łączy się z nim kowalencyjne wiązania, tworząc nową substancję, że w tym przypadku jest eter.
Podczas reakcji występuje przemieszczenie jonu halogenkowego, który zastępuje anion alcoxide. Ta reakcja jest znana jako synteza eterów Williamsona.
Ilość uzyskanego produktu i prędkość, z jaką jest wytwarzany, będą zależeć od stężenia zaangażowanych reagentów, ponieważ jest to reakcja kinetyczna drugiego rzędu, w której zderzenie cząsteczek (nukleofil + alkilowo -halogened) określa jego skuteczność.
Procedura
Krok 1
Aby zainicjować syntezę kwasu fenoksyoctowego, 0,5 granie fenolu jest bardzo ostrożne i umieszczone w kolbie w kształcie gruszki i pojedynczej usta, o pojemności 50 ml. 2,5 ml wodorotlenku sodu (NaOH) dodaje się do 33% (P/V) w celu jego rozpuszczenia.
Sprawdź zasadowość roztworu za pomocą papieru wskaźnika pH. Umieść pokrywkę korka do kolby i przez 5 minut mocno mieszaj. Do mieszanki możesz użyć mieszadnika magnetycznego.
Krok 2
Następnie dodaj 0,75 g kwasu monochlorooctowego i powtórz procedurę mieszania przez 5 minut.
W przypadku, gdy mieszanina stara się stwardnieć lub stać się ciasta, można dodać wodę (od 1 do 3 ml), ale jest to stopniowo dodawane, dopóki nie powróci do poprzedniego kontekstu, bez rozcieńczenia zbyt dużego rozcieńczenia.
Krok 3
Odkryj kolbę i umieść ją w kąpieli Marii, która ma system refluksu przez 10 minut. Jeśli system przepływu nie jest dostępny przez 40 minut.
Krok 4
Niech roztwór ostygnie i dodaj 5 ml wody, a następnie zakwaszić stężonym roztworem HCl, aż osiągniesz pH 1. (Zmierz pH za pomocą papieru do tego celu).
Może ci służyć: chlorek amonu (NH4Cl)Krok 5
Przekaż mieszaninę ostrożnie przez ścieżkę separacji i usuń trzykrotnie, używając 5 ml eteru etylowego w każdej procedurze.
Jeden extrica organiczny i zastępuje w lejku separacji, aby wykonać trzykrotną wodę, używając 5 ml wody w każdym myciu.
Frakcje wodne są oddzielone, aby je odrzucić.
Krok 6
Następnie frakcja organiczna jest ekstrahowana 3 ml węglanu sodu (NA2WSPÓŁ3) 15% trzy razy.
Otrzymany ekstrakt wodny alkaliczny jest umieszczany w łaźni lodowej i jest zakwaszony za pomocą HCl do pH = 1, co generuje wytrącanie produktu. Krok zakwaszania należy wykonać bardzo ostrożnie, dodając kropla po kropli, ponieważ reakcja generuje piankę, a jeśli jest nagle dodana.
Stolizna jest uzyskiwana przez filtrację próżniową, osad jest myty i pozwala wyschnąć.
Krok 7
Otrzymany produkt jest ważny, a wydajność i temperatura topnienia jest widoczna.
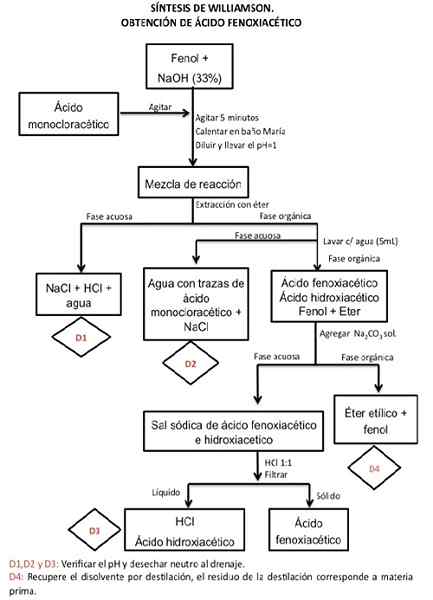 Źródło: Sandoval M. (2015). Organiczne praktyki laboratorium chemicznego Podręcznik II. National Autonomous University of Mexico Wydział Chemii.
Źródło: Sandoval M. (2015). Organiczne praktyki laboratorium chemicznego Podręcznik II. National Autonomous University of Mexico Wydział Chemii. Aplikacje
Sam kwas fenoksyoctowy ma aktywność grzybobójczą przeciwko niektórym grzybom, takim jak Candida albicans i Trichophyton Rubrum. Działanie to zostało opisane w dochodzeniu przeprowadzonym przez González i współpracowników.
Prace ujawniły, że minimalne stężenie hamujące lub grzybowe (CMI) i minimalne stężenie fungicydów (CMF) były takie same (2,5 mg/ml) dla 13 gatunków z Candida albicans z próbek klinicznych, w szczególności pacjentów cierpiących na onychomykozę.
Podczas gdy szczep Candida albicans ATCC 10231 przedstawił CMI 2,5 mg/ml i CMF 5,0 mg/ml. Ze swojej strony, Trichophyton Rubrum przedstawił CMI 0.313 mg/ml i CMF 1.25 mg/ml w 8 szczepach analizowanych z zainfekowanych paznokci.
Ponadto kwas fenoksyoctowy jest bardzo przydatny jako złuszczający keratyna, dlatego jest w stanie zminimalizować mawiusy lub ziarna na dotkniętej skórze z tymi cechami.
Z drugiej strony kwas fenoksyoctowy jest surowcem do syntezy pestycydów, szczególnie herbicydów, takich jak Astix i Duposan.
Może ci służyć: kwas siarczkowy (H2S): struktura, właściwości, zastosowania, znaczenieRyzyko
Jeśli produkt zostanie przypadkowo połknięty, spowoduje podrażnienie błon śluzowych w całym przewodzie pokarmowym (usta, przełyk, żołądek i jelita).
Jeśli zostanie wdychany, spowoduje podrażnienie błony śluzowej oddechu, powodując niewydolność oddechową i kaszel.
Na skórze może powodować łagodne podrażnienie. Podczas gdy podrażnienie błony śluzowej oka będzie poważniejsze. W takich przypadkach zaleca się mycie dotkniętego obszaru obfitą wodą i wodą.
Ten produkt był powiązany jako czynnik predysponujący stan lub pojawienie się guzów tłuszczowych. Guzy te zwykle rozwijają się częściej w kończynach lub brzuchu.
Z drugiej strony, produkt ten jest klasyfikowany jako niefalowy do transportu zgodnie z kryteriami opisanymi przez przepisy transportowe.
Pestycydy pochodzące z kwasu fenoksyoctowego, jeśli zwykle są toksyczne dla środowiska i są związane z mutacjami genetycznymi, szczególnie z translokacją T występującą w chłoniaku nieziarniczym u ludzi.
Środki ostrożności
- Ten produkt musi być trzymany z dala od silnych środków utleniających i zasad, które mogą gwałtownie reagować.
- Ważne jest, aby uniknąć ogrzewania tego produktu.
- Manipulować za pomocą środków ochrony, takich jak rękawiczki, suknia, soczewki bezpieczeństwa.
Bibliografia
- González G, Trujillo R. Kwas fenoksyoctowy, identyfikacja i oznaczanie jego działań przeciwgrzybiczych In vitro przeciw Candida albicans i Trichophyton Rubrum. Obrót silnika. peruwiański Wydziału Pharmacy, 1998; 34 (109). Dostępne w: Unmsm.Edu
- „Kwas fenoksyoctowy”. Wikipedia, bezpłatna encyklopedia. 13 maja 2014, 17:21 UTC. 13 maja 2014, 17:21 Wikipedia.org
- Merck Laboratories. Arkusz danych dotyczących bezpieczeństwa. 2017. Dostępne na: TES.UABC.MX/
- Aventis Laboratories. Arkusz danych bezpieczeństwa Advisis. 2001. Dostępne na: affe.Cl
- Gutiérrez m. Fenoksyoctic w sytuacjach awaryjnych. Ciatox Toxox Informacje i porady. National University of Kolumbia. Dostępne na: Enforn.com
- Sandoval m. (2015). Organiczne praktyki laboratorium chemicznego Podręcznik II. National Autonomous University of Mexico Wydział Chemii.
- Merck Laboratories. Arkusz danych bezpieczeństwa zgodnie z rozporządzeniem CE nr. 1907/2006. 2015 Dostępny na: ESE.UABC.MX/
- Berzal-Calejo M, Herranz-Torrubian A, Cuenca-González C. Guz tłuszczowy z objawami alarmowymi. Rev clín med fam 2015, 8 (3): 246-250. Dostępne na: Scielo.ISCIII.To jest/Scielo.
- Matheus T, bolaños a. Micronúcleos: biomarker genotoksyczności narażony na pestycydy. Salus, 2014; 18 (2): 18-26. Dostępne w: ve.Scielo.org
- « +380 Typowe i popularne chilijskie powiedzenia
- Cozumel Arreciphes Charakterystyka parku narodowego, pogoda, flora, fauna »

