Kolarstwo
- 731
- 19
- Paweł Malinowski
 Cucloalquinos
Cucloalquinos Jakie są cykloalquinos?
Kolarstwo Są to związki organiczne, które mają jedno lub więcej potrójnych linków i jednostkę cykliczną. Jego skondensowane wzory molekularne są posłuszne wzór CNH2n-4. Zatem, jeśli n jest równe 3, wówczas wzór wspomnianego cykloalquino będzie C3H2.
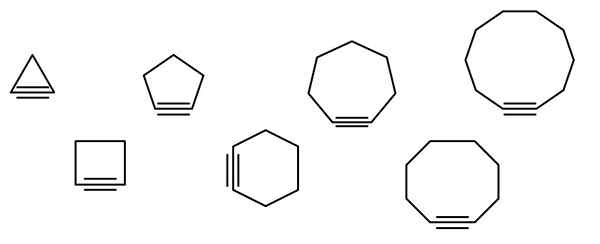
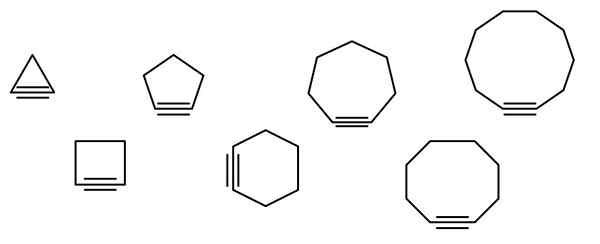
Na obrazie wyższym ilustrując serię postaci geometrycznych, ale w rzeczywistości składa się z przykładów cykloalquinów. Każdy z nich można uznać za bardziej utlenioną wersję odpowiednich cykloalcanos (bez podwójnych lub potrójnych linków). Kiedy brakuje im heteroátomo (o, n, s, f itp.), są tylko „prostymi” węglowodorami.
Chemia wokół Cycloalquinos jest bardzo złożona, a za ich reakcjami stoi jeszcze więcej mechanizmów. Reprezentują punkt wyjścia do syntezy wielu związków organicznych, które z kolei podlegają możliwym zastosowaniu.
Ogólnie rzecz biorąc, są one bardzo reaktywne, chyba że są „zniekształcone” lub tworzą złożone z metali przejściowych. Ponadto ich potrójne wiązania można łączyć z podwójnymi wiązaniami, tworząc cykliczne jednostki wewnątrz cząsteczek.
Nie tak, w swoich najprostszych strukturach są w stanie dodać małe cząsteczki do swoich potrójnych wiązań.
Charakterystyka cykloalquin
Apolarność i link potrójny
Cyclesses charakteryzuje się byciem cząsteczkami apolarnymi, a zatem hydrofobowym. Może się to zmienić, jeśli w ich strukturach mają jakąkolwiek heteroátomo lub grupę funkcjonalną, która nadaje znaczny moment dipolowy; jak w heterocyklach z potrójnymi linkami.
Ale co to jest potrójne link? To nic więcej niż trzy jednoczesne interakcje między dwoma atomami węgla z hybrydyzacją SP. Link jest prosty (σ), a pozostałe dwa π, prostopadłe do siebie. Oba atomy węgla mają swobodny Orbital SP, aby połączyć inne atomy (R-C≡C-R).
Może ci służyć: radykalne do wynajęcia: jak są tworzone, nomenklatura, przykładyTe hybrydowe orbitale mają 50% S i 50% znaku P. Ponieważ orbital S są bardziej penetrujące niż P, fakt ten sprawia, że dwa węglowodory potrójnego wiązania więcej kwasów (akceptory elektronów).
Z tego powodu potrójne wiązanie (≡) stanowi konkretny punkt dla gatunków dawcy elektronów do dodania do niego, tworząc proste linki.
Powoduje to pęknięcie jednego z łączy π, stając się podwójnym łączem (C = C). Dodatek trwa aż do r4C-CR4, to znaczy całkowicie nasycone węgle.
Powyższe można również wyjaśnić w ten sposób: Triple Link to podwójne nienasycenie.
Siły międzycząsteczkowe
Cząsteczki cykloalcyny oddziałują poprzez siły dyspersji lub siły Londynu i interakcje typu π-X. Te interakcje są słabe, ale wraz ze wzrostem wielkości cykli (podobnie jak ostatnie trzy po prawej stronie obrazu), udaje im się utworzyć ciśnienie ciśnienia w temperaturze i ciśnieniu otoczenia.
Napięcie kątowe
Triple Links znajdują się na tym samym samolocie i linii. Dlatego -C≡C- ma geometrię liniową, z orbitaliami około 180º.
Ma to poważne zaangażowanie w stereochemiczną stabilność cykloalquinów. Do „składania” orbitali SP wymaga dużo energii, ponieważ nie są one elastyczne.
Im mniejszy cykloalquino, tym bardziej należy składać Orbital SP, aby umożliwić fizyczne istnienie tego samego. Analizując obraz, można zauważyć, od lewej do prawej, że w trójkącie kąt linków do boków potrójnego łącza jest bardzo wyraźny; Podczas gdy w decagonie są mniej nagle.
Może ci służyć: niebieski metylen: charakterystyka, przygotowanie, zastosowaniaPonieważ Cycloalquino jest większy, kąt linków orbitalnej SP do ideałów 180º. Odwrotnie dzieje się, gdy są mniejsze, zmuszając ich do zginania się i tworzenia napięcie kątowe W nich instalacja cykloalquino.
Zatem największe cykloalquiny mają niższe napięcie kątowe, co umożliwia ich syntezę i przechowywanie. Dzięki temu trójkąt jest najbardziej niestabilnym cyklem, a decagon jest najbardziej stabilny ze wszystkich.
W rzeczywistości cyklooktyna (ośmiokąt) jest tą, która ma najmniejszą znaną bardziej stabilną; inne istnieją tylko jako chwilowe pośredniki w reakcjach chemicznych.
Nomenklatura rowerowa
Wyznaczyć cykle. Jedyna różnica polega na sufiksie -ico na końcu nazwy związku organicznego.
Główny łańcuch to taki, który ma potrójne połączenie i zaczyna być wyliczana od najbliższego końca. Jeśli masz na przykład cyklopropan. Jeśli grupa metylowa jest połączona z górnym wierzchołkiem, będzie to: 2-metylocyklopropino.
Węgi R-C≡C-R ma już cztery wiązania, więc brakuje im hydrogenów (jak w przypadku wszystkich cykloalquinów obrazu). Nie zdarza się to tylko wtedy, gdy potrójne łącze znajduje się w pozycji końcowej, to znaczy na końcu łańcucha (R-C≡C-H).
Zastosowania cykloalquine
Cykloalkany nie są bardzo powszechnymi związkami, więc ich zastosowania też nie są. Mogą służyć jako segregatory (grupy koordynowane) do przejścia metali, tworząc w ten sposób nieskończoność związków organometalicznych, które mogą być przeznaczone do bardzo rygorystycznych i specyficznych zastosowań.
Może ci służyć: bisulfit sodu (NaHSO3): struktura, właściwości, użycia, uzyskiwanieZazwyczaj są rozpuszczalnikami w swoich najbardziej nasyconych i stabilnych postaciach. Kiedy składają się one z heterocykli, oprócz posiadania jednostek cyklicznych C≡C-C = C-C≡C, znajdują interesujące i obiecujące zastosowania, takie jak leki przeciwnowotworowe; Tak jest w przypadku diemicyny. Inne związki o analogiach strukturalnych zsyntetyzowały z niego.
Przykłady cykloquinos
Obraz pokazuje siedem prostych cykloalquinów, w których prawie nie ma potrójnego linku. Od lewej do prawej, z odpowiednimi nazwami: Cyklopropino, trójkąt; Ciclobutino, plac; Cykopentyna, Pentagon; Cyclohexino, Hexagon; Cycloheptino, heptagon; Cyclooctino, Octagon; i Cyclodecino, decagon.
Na podstawie tych struktur i zastępując atomy wodoru nasyconych węgli, można uzyskać inne związki. Mogą również przejść warunki oksydacyjne, aby wygenerować podwójne łącza po innych stronach cykli.
Te jednostki geometryczne mogą być częścią większej struktury, zwiększając szanse funkcjonalizowania całego zestawu. Nie ma wielu dostępnych przykładów cykloalcynów, przynajmniej nie bez pogłębienia ziem organicznych i farmakologii.
Bibliografia
- Francis a. Szylkret. Chemia organiczna. (Szósta edycja., Strona 372, 375). MC Graw Hill.
- Wikipedia. (2018). Cycloalkyne. Zaczerpnięte z: w.Wikipedia.org
- William Reusch. (05 maja 2013). Nazywanie związków organicznych. Zaczerpnięte z: 2.Chemia.MSU.Edu
- Chemia nieorganiczna. Kolarstwo. Zaczerpnięte z: Fullquimica.com
- Patrizia Diana i Girolamo Cirrincione. (2015). Biosynteza heterocykli od izolacji do klastra genów. Wiley, strona 181.
- Ciekawa chemia organiczna i produkty naturalne. (17 kwietnia 2015 r.). Cycloalkynes. Zaczerpnięte z: Quintus.Mickel.Ch

