Struktura węgla wapnia (CAC2), właściwości, uzyskiwanie, zastosowania

- 4999
- 1348
- Maksymilian Kępa
On Węglenie wapnia Jest to związek nieorganiczny utworzony przez pierwiastki wapnia (CA) i węglowe (C) (C). Jego formuła chemiczna to CAC2. Jest to substancja stała, która może być bezbarwna do żółtawej lub szarawej bieli, a nawet czarna w zależności od zanieczyszczeń, które zawiera.
Jedna z jego najważniejszych reakcji chemicznych CAC2 to ten, który występuje z wodą h2Lub, w którym hC≡CH tworzy się acetylen. Dlatego służy do uzyskania acetylenu przemysłowego. Ze względu na tę samą reakcję wody jest używana do dojrzewania owoców, w fałszywych armatach i flachach morskich.
 Węglenie wapnia CAC2 solidny. Domena Ondřej Mang / pub. Źródło: Wikimedia Commons.
Węglenie wapnia CAC2 solidny. Domena Ondřej Mang / pub. Źródło: Wikimedia Commons. Reakcja CAC2 Z wodą wytwarza również użyteczne błoto do przygotowania klinkieru (składnik cementu), który wytwarza mniej dwutlenku węgla (CO2) W porównaniu z tradycyjną metodą wytwarzania cementu.
Z azotem (n2) Karen wapnia w kształcie cyjanamidu wapnia, który jest stosowany jako nawóz. CAC2 Służy również do usuwania siarki z niektórych stopów metali.
Jakiś czas temu CAC2 Był używany w lampionach węglików, ale nie są one już bardzo powszechne, ponieważ są niebezpieczne.
[TOC]
Struktura
Karen wapnia jest związkiem jonowym i jest tworzone przez CA Calcio Ion2+ oraz węglika lub acetylouro C22-. Jon węglikowy składa się z dwóch atomów węgla zjednoczonych z potrójną wiązaniem.
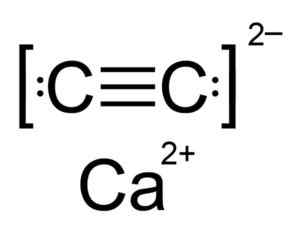 Struktura chemiczna węgliku wapnia. Autor: Hellbus. Źródło: Wikimedia Commons.
Struktura chemiczna węgliku wapnia. Autor: Hellbus. Źródło: Wikimedia Commons. Krystaliczna struktura CAC2 Pochodzi z sześciennego (takiego jak chlorek sodu), ale podobnie jak jon c22- Struktura jest wydłużona jest zniekształcona i zmienia się tetragonalne.
Nomenklatura
- Węglenie wapnia
- Węglenie wapnia
- Acetyl wapnia
Nieruchomości
Stan fizyczny
Krystaliczne stałe, że gdy czysty jest bezbarwny, ale jeśli jest zanieczyszczony innymi związkami, może być żółtawy lub szarej do czarnego.
 Węglenie wapnia CAC2 Z zanieczyszczeniami. Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Węglenie wapnia CAC2 Z zanieczyszczeniami. Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Waga molekularna
64 0992 g/mol
Może ci służyć: Alilo: Allyic Unit, Carbocation, Radical, przykładyTemperatura topnienia
2160 ° C
Punkt wrzenia
CAC2 gotuje się w 2300 ° C z rozkładem. Temperatura wrzenia powinna być mierzona w obojętnej atmosferze, to znaczy bez tlenu lub wilgoci.
Gęstość
2,22 g/cm3
Właściwości chemiczne
Karen wapnia reaguje z wodą, tworząc HC≡CH acetylen i wodorotlenek wapnia CA (OH)2:
CAC2 + 2 godz2O → HC≡CH + CA (OH)2
Acetylen jest łatwopalny, dlatego w obecności wilgoci CAC2 Może być łatwopalne. Jednak gdy jest suchy, nie jest.
 Węglenie wapnia CAC2 Z wodą hctorsch acetylenową, łatwopalne związki. Kristina Kravets/CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Węglenie wapnia CAC2 Z wodą hctorsch acetylenową, łatwopalne związki. Kristina Kravets/CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Węglenie wapnia reaguje z azotem n2 Tworząc CACN CALTIO Cyanamid2:
CAC2 + N2 → Cacn2 + C
Uzyskanie
Węglenie wapnia jest wytwarzane przemysłowo w elektrycznym piekarniku łukowym opartym na mieszaninie węglanu wapnia (CACO3) i węgiel (c), który jest przedłożony w temperaturze 2000 ° C. Reakcja jest podsumowana w następujący sposób:
Złodziej3 + 3 C → CAC2 + CO ↑ + CO2↑
Lub także:
CAO + 3 C → CAC2 + CO ↑
W elektrycznym piekarniku łukowym znajduje się łuk elektryczny między dwiema elektrodami grafitowymi, które odporne są na tworzone wysokie temperatury. Uzyskuje się węglika wapnia o czystości 80-85%.
Aplikacje
W produkcji acetylenu
Przemysłowo stosuje się reakcję węgla wapnia z wodą w celu wytworzenia acetylenu C2H2.
CAC2 + 2 godz2O → HC≡CH + CA (OH)2
Jest to najważniejsze zastosowanie węglika wapnia. W niektórych krajach acetylen jest bardzo mile widziany, ponieważ pozwala wytwarzać chlorek poliwinylu, który jest rodzajem plastiku. Ponadto acetylen służy do wykonywania spoin w wysokich temperaturach.
 Metaly płomienia acetylenowego HC≡CH w bardzo wysokich temperaturach. Autor: Shutterbug75. Źródło: Pixabay.
Metaly płomienia acetylenowego HC≡CH w bardzo wysokich temperaturach. Autor: Shutterbug75. Źródło: Pixabay. W zmniejszaniu emisji CO2
Pozostałości uzyskane od uzyskania acetylenu zaczynającego się od CAC2 (zwane także „osadem węglika wapnia” lub „resztami węglika wapnia”). Służą one do użycia do uzyskania klinkieru lub betonu.
Może ci służyć: zastosowanie technologiczne elektronicznej emisji atomówMłoto z węglika wapnia ma wysoką zawartość wodorotlenku wapnia (CA (OH)2) (około 90%), trochę węglanu wapnia (CACO3) i ma pH większy niż 12.
 W aktywności budowlanej można zastosować resztki węglika wapnia w celu przygotowania betonu, zmniejszając w ten sposób wytwarzanie CO2 wspomnianego przemysłu. Autor: Engin Akyurt. Źródło: Pixabay.
W aktywności budowlanej można zastosować resztki węglika wapnia w celu przygotowania betonu, zmniejszając w ten sposób wytwarzanie CO2 wspomnianego przemysłu. Autor: Engin Akyurt. Źródło: Pixabay. Z tych powodów możesz zareagować z SIO2 lub al2ALBO3 tworząc produkt podobny do uzyskanego przez proces nawodnienia cementu.
Jedna z działań ludzkich, która wytwarza najwięcej współistniejących2 To jest branża budowlana. Co2 Jest generowany na wschód od węglanu wapnia podczas reakcji w celu utworzenia betonu.
Użycie błota węglika wapnia w celu wymiany węglanu wapnia (CACO3) Stwierdzono, że emisje CO -redukowane są2 W 39%.
Przy uzyskaniu cyjanamidu wapnia
Karen wapnia jest również wykorzystywany przemysłowo w celu uzyskania CACN cyjanamidu wapnia2.
CAC2 + N2 → Cacn2 + C
Cyanamid wapnia ma zastosowanie jako nawóz, ponieważ z wodą gleby staje się cyjanamidem H2N = c = n, który zapewnia azot roślinom, co jest niezbędnym dla nich składnikami odżywczymi.
W branży metalurgicznej
Węglenie wapniowe służy do usuwania stopów, takich jak Ferroníquel. CAC jest mieszany2 Z stopionym stopem w 1550 ° C. Siarka reaguje z węglikiem wapniowym i siarczkiem wapnia Cas i węglem C:
CAC2 + S → 2 C + CAS
Usunięcie siarki jest preferowane, jeśli mieszanie jest wydajne, a zawartość węgla w stopach jest niska. Siarczek wapnia Casclium unosi się na powierzchni stopionego stopu, gdzie opiera się i odrzuca.
W kilku zastosowaniach
W węgliku wapnia zastosowano do eliminacji siarki żelaza. Również jako paliwo w produkcji stali i jako potężny deoksydant.
Może ci służyć: aromatyczne podstawienie elektrofilowe: mechanizm i przykładySłuży do dojrzewania owoców. Z węgliku wapnia z wodą generowana jest acetylen, co indukuje dojrzewanie owoców, takich jak banany.
 Banany mogą dojrzewać za pomocą węgliku wapnia CAC2. Autor: Zdjęcia Alexas. Źródło: Pixabay.
Banany mogą dojrzewać za pomocą węgliku wapnia CAC2. Autor: Zdjęcia Alexas. Źródło: Pixabay. Węglenie wapnia jest używane w fałszywych armatach, aby spowodować głośny hałas wybuchowy, który je charakteryzuje. Tutaj stosuje się również formacja acetylenu, która eksploduje z iskrą w artefakcie.
CAC2 Służy do generowania sygnałów na wysokich morzach w marynarce wojennej.
Przerwane użycie
CAC2 Był używany w lampionach węglików SO. Ich działanie polega na kapaniu wody na węgliku wapnia w celu utworzenia acetylenu, który włącza się, a zatem zapewnia światło.
Lampy te zastosowano w kopalniach węgla, ale ich użycie zostało przerwane z powodu obecności Cho Metan Gas4 W tych kopalniach. Ten gaz jest łatwopalny, a płomień lampy z węglikiem.
 CAC WAGIB CAGUM LAMPE2. Domena scehardt / pub. Źródło: Wikimedia Commons.
CAC WAGIB CAGUM LAMPE2. Domena scehardt / pub. Źródło: Wikimedia Commons. Były szeroko stosowane w kopalniach skalnych, miedzi i cyna, a także w pierwszych samochodach, motocyklach i rowerach, takich jak przednie światła lub reflektory.
Obecnie zostały zastąpione lampami elektrycznymi, a nawet lampami LED. Jednak są one nadal używane w krajach takich jak Boliwia, w kopalniach srebrnych Potosí.
Ryzyko
Węglenie wapnia CAC2 suche nie jest łatwopalne, ale w obecności acetylenu wilgoci, czyli.
Gasić ogień w obecności CAC2 Woda, piana, dwutlenek węgla lub gaśnice halogenowe nigdy nie należy stosować. Należy zastosować wodorotlenek sodu lub wapnia.
Bibliografia
- Ropp, r.C. (2013). Grupa 14 (C, SI, GE, SN i PB) Związki Ziemi alkalicznej. Węgasy wapnia. W encyklopedii alkalicznych związków Ziemi. Odzyskane z naukowym.com.
- Pohanish, r. P. (2017). C. Wapń z węglikiem. W podręczniku Sittig z toksycznych i niebezpiecznych chemikaliów i raków (wydanie siódme). Odzyskane z naukowym.com.
- Słońce, h. i in. (2015). Właściwości chemicznie pochłanionego węglika wapnia ponownie i jego winfisję na właściwości cementu. Materiały 2015, 8, 638-651. NCBI odzyskało.NLM.Nih.Gov.
- Nie, Z. (2016). Ekologiczne i oceny cyklu życia. Studium przypadku: CO2 Analiza emisji klinkieru szlamu z węglika wapnia. W zielonej i zrównoważonej produkcji zaawansowanych materiałów. Odzyskane z naukowym.com.
- Crundwell, f.K. I in. (2011). Rafinowanie stopionego Ferronickel. Siarka do usunięcia. W metalurgii ekstrakcyjnej metali niklu, kobaltu i platyny. Odzyskane z naukowym.com.
- Tressler, r.I. (2001). Ceramika strukturalna i termostrukturalna. Węgliki. W Encyklopedii Materials Science and Technology. Odzyskane z naukowym.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- « 10 korzyści z codziennego biegania dla zdrowia
- Wartości moralne Charakterystyka, szkolenie i przykłady »

