Struktura węglanu aluminium, właściwości, wykorzystują
- 719
- 17
- Matylda Duda
On Węglan aluminiowy Jest to sól nieorganiczna, której wzorem chemicznym jest2(WSPÓŁ3)3. Jest to praktycznie nieistniejący węglan metalu, biorąc pod uwagę jego wysoką niestabilność w normalnych warunkach.
Wśród przyczyn jego niestabilności możemy wspomnieć o słabych interakcjach elektrostatycznych między jonami do3+ i co32-, które teoretycznie powinny być bardzo silne dla wielkości ich obciążeń.
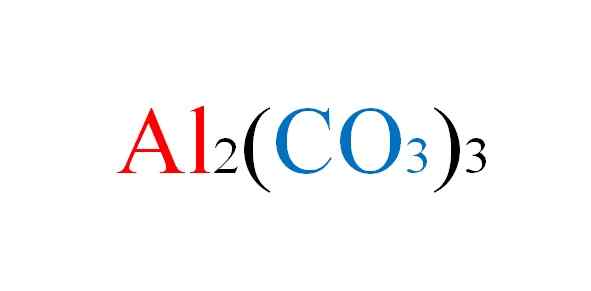 Aluminiowy wzór węglanowy. Źródło: Gabriel Bolívar.
Aluminiowy wzór węglanowy. Źródło: Gabriel Bolívar. Sól napotyka wszelkie niedogodności w papierze, gdy zapisane są równania chemiczne ich reakcji; Ale w praktyce jest to przeciwko temu.
Pomimo tego, co zostało powiedziane, w towarzystwie innych jonów może wystąpić węglan aluminiowy, jak ma to miejsce w przypadku minerału Dawsonite. Istnieje również pochodna, w której oddziałuje on z wodnym amoniakiem. Reszty jest uważany za mieszaninę między al (OH)3 i H2WSPÓŁ3; który jest równy musującemu roztworze z białym osadem.
Ta mieszanka ma zastosowania lecznicze. Jednak do czystej, izolowanej i manipulacyjnej soli Al2(WSPÓŁ3)3, Nie znasz możliwych aplikacji; Przynajmniej nie niskie ogromne ciśnienie lub ekstremalne warunki.
[TOC]
Struktura węglanu aluminium
Krystaliczna struktura tej soli jest nieznana, ponieważ jest tak niestabilna, że nie można go scharakteryzować. Od jego formuły do2(WSPÓŁ3)3, Wiadomo jednak, że odsetek jonów do3+ i co32- To jest 2: 3; to znaczy na każde dwa kationów2+ Musi być trzy aniony co32- interakcja elektrostatycznie z nimi.
Problem polega na tym, że oba jony są bardzo nierówne w odniesieniu do swoich rozmiarów; Al3+ Jest bardzo mały, a CO32- Jest nieporęczny. Ta różnica sama już wpływa na stabilność siatkową sieci krystalicznej, której jony oddziaływałyby „niezręcznie”, gdyby ta sól w stanie stałym jest izolowana.
Może ci służyć: Avogadro Numer: History, jednostki, jak jest obliczane, używaOprócz tego aspektu Al3+ Jest to wysoce polaryzujące kation, właściwość, która deformuje elektroniczną chmurę CO32-. To tak, jakby chciał go zmusić do powiązania kowalencyjnego, nawet jeśli anion nie może tego zrobić.
W konsekwencji interakcje jonowe między AL3+ i co32- Mają tendencję do kowalencji; Kolejny czynnik, który zwiększa niestabilność Al2(WSPÓŁ3)3.
Węglan hydroksydowy aluminium amon
Chaotyczny związek między AL3+ i co32- Zmiękcza wygląd, gdy w szkle występują inne jony; takie jak NH4+ I och-, Z roztworu amoniaku. Ten kwartet jonowy do3+, WSPÓŁ32-, NH4+ I och-, Udaje im się zdefiniować stabilne kryształy, nawet zdolne do przyjmowania różnych morfologii.
Inny przykład podobny do tego obserwuje się w minerałach Dawsonite i jego kryształach ortorrombowych, naalco3(OH)2, Gdzie na+ Wymień NH4+. W tych sole ich wiązania jonowe są wystarczająco silne, aby woda nie promowała uwalniania CO2; A przynajmniej nie nagle.
Chociaż NH4AL (OH)2WSPÓŁ3 (AACC, za jego sigles w języku angielskim), ani Naalco3(OH)2 Reprezentują węglan aluminiowy, można je uznać za podstawowe pochodne tego samego.
Nieruchomości
Masa cząsteczkowa
233,98 g/mol.
Niestabilność
W poprzednim rozdziale wyjaśniono z perspektywy molekularnej, dlaczego Al2(WSPÓŁ3)3 Jest niestabilny. Ale jaka transformacja cierpi? Musisz rozważyć dwie sytuacje: jeden suchy, a drugi „mokry”.
Suchy
W sytuacji suchej Anion CO32- Co jest odwrócone2 Poprzez następujący rozkład:
Do2(WSPÓŁ3)3 => Al2ALBO3 + 3co2
Może ci służyć: fosforan wapnia (CA3 (PO4) 2)Co ma sens, jeśli jest zsyntetyzowany pod glinu do dużych presji CO2; to znaczy odwrotna reakcja:
Do2ALBO3 + 3co2 => Al2(WSPÓŁ3)3
Dlatego, aby uniknąć rozkładu Al2(WSPÓŁ3)3 Musiałbyś przesłać sól do wielkich presji (używając n2, Na przykład). W ten sposób tworzenie CO2 nie byłby faworyzowany termodynamicznie.
Mokry
Podczas gdy w mokrej sytuacji CO32- Cierpi hydroliza, która generuje niewielkie ilości OH-; Ale wystarczy, aby wodorotlenek aluminiowy wytrącił się, w (OH)3:
WSPÓŁ32- + H2Lub HCO3- + Oh-
Do3+ + 3oh- AL (OH)3
A z drugiej strony Al3+ Jest również zhydrolizowany:
Do3+ + H2Lub do (OH)22+ + H+
Chociaż byłoby to naprawdę nawodnione3+ Tworzyć kompleks (h2ALBO)63+, który jest zhydrolizowany, aby [(H2ALBO)5Oh]2+ i H3ALBO+. Potem h3Lub (lub h+) Protona to CO32- do h2WSPÓŁ3, który załamuje się do CO2 i H2ALBO:
WSPÓŁ32- + 2h+ => H2WSPÓŁ3
H2WSPÓŁ3 WSPÓŁ2 + H2ALBO
Zauważ, że ostatecznie Al3+ Zachowuje się jak kwas (uwalnianie h+) i baza (wydanie OH- Z równowagą rozpuszczalności Al (OH)3); to znaczy wykazuje amfoteryzm.
Fizyczny
Aby móc się odizolować, ta sól może być biała, podobnie jak wiele innych soli aluminiowych. Ponadto, ze względu na różnicę między radiami jonowymi Al3+ i co32-, Z pewnością miałby bardzo niskie temperatury topnienia lub wrzenia w porównaniu z innymi związkami jonowymi.
Może ci służyć: Benchilo: hydrogeny benzylowe, karbokacje, rodniki benzyloweA jeśli chodzi o jego rozpuszczalność, byłby nieskończenie rozpuszczalny w wodzie. Ponadto byłby to higroskopijny i pyszny stał. Są to jednak tylko przypuszczenia. Inne właściwości musiałyby zostać oszacowane za pomocą modeli obliczeń podlegających wysokim ciśnieniu.
Aplikacje
Zastosowania znane z węglanu aluminium są medyczne. Został zastosowany jako miękki ściągający i jako lek w leczeniu zapalenia i wrzodu żołądka. Zastosowano go również w celu zapobiegania tworzeniu obliczeń moczowych u ludzi.
Zastosowano go do kontrolowania wzrostu zawartości ciała w fosforanach, a także do leczenia objawów kwasowości żołądka, niestrawności kwasu i owrzodzeń żołądka.
Bibliografia
- Xuehui l., Zhe t., Yongming c., Ruiyu z. I Chenguang L. (2012). Hydrotermalna synteza nanoplatletetów węglanowych (AACH) i nanowłókna morfologie kontrolowane przez pH. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Aluminiowe węglan amonu NH4AL (OH) 2CO3 jako alternatywna trasa do przygotowywania aluminium:. Technologia proszku, 320, 565-573, doi: 10.1016/j.Powec.2017.07.0080
- National Center for Biotechnology Information. (2019). Węglan aluminiowy. Baza danych Pubchem., CID = 1035396. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2019). Węglan aluminiowy. Źródło: w:.Wikipedia.org
- Aluminumsulfate. (2019). Węglan aluminiowy. Odzyskane z: aluminumulfate.internet

