Funkcje i funkcje pudełka Tata
- 3006
- 821
- Bertrand Zawadzki
Tata Box, W biologii komórkowej jest to konsensusowa sekwencja DNA, która występuje we wszystkich liniach żywych organizmów i jest szeroko zachowana. Sekwencja to 5'-tataaa-3 'i może śledzić powtarzane adeniny.
Lokalizacja pudełka jest powyżej (lub rzeka powyżej, jak zwykle nazywa się to w literaturze) na początku transkrypcji. Znajduje się w promotorze genów, gdzie nastąpi związek z czynnikami transkrypcyjnymi. Oprócz tych czynników polimeraza RNA II zwykle łączy się z pudełkiem TATA.
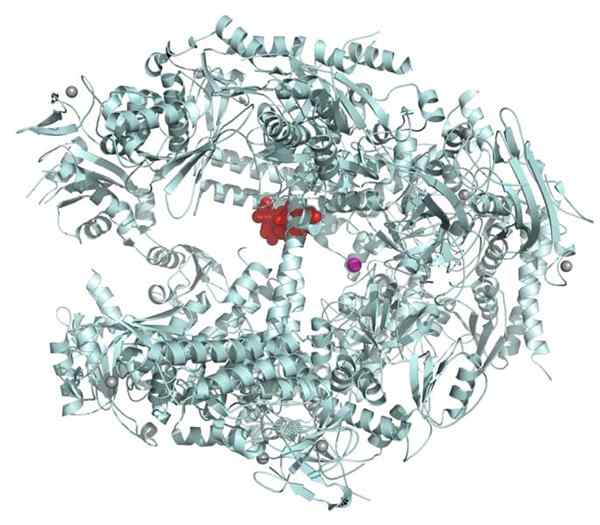
 Polimeraza RNA II. Źródło: Fvasconcellos 21:15, 14 listopada 2007 (UTC) [domena publiczna]
Polimeraza RNA II. Źródło: Fvasconcellos 21:15, 14 listopada 2007 (UTC) [domena publiczna] Chociaż pudełko TATA jest główną sekwencją promotora, istnieją geny, których tego brakuje.
[TOC]
Charakterystyka
Początek syntezy RNA wymaga zjednoczenia polimerazy RNA przez określone sekwencje DNA, zwane promotorami. Tata caja jest konsensusową sekwencją promotora. Nazywa się to PriBiew Box w prokariotach, a Goldberg-Hogness Box w eukariotach.
Zatem pudełko Tata jest regionem zachowanym w DNA. Sekwencjonowanie wielu regionów początkowej transkrypcji DNA wykazało, że sekwencja konsensusowa lub wspólna sekwencja wynosi (5ʾ) t*a*taat*(3ʾ). Pozycje oznaczone gwiazdką mają wysoką homologię. Ostatnia pozostałość T jest zawsze w promotorach I. coli.
Lokalizacja pudełka Tata w Procariotas
Zgodnie z konwencją pary zasad odpowiadające początkowi syntezy cząsteczki RNA otrzymują liczby dodatnie, a pary zasad poprzedzające początek RNA otrzymują liczby ujemne. Pudełko tata znajduje się w regionie -10.
Może ci służyć: erytroblasty: czym są erytropoiesis, powiązane patologieW I. coli, Region promotora znajduje się między pozycjami -70 i +30. W tym regionie istnieje druga sekwencja konsensusu (5ʾ) t*tg*aca (3ʾ) w pozycji -35. Podobnie pozycje oznaczone gwiazdką mają wysoką homologię.
Lokalizacja skrzynki Tata w eukarionotach
W eukariotach regiony promujące mają elementy sygnałowe, które różnią się dla każdego z polimerazy RNA. W I. coli Pojedyncza polimeraza RNA identyfikuje elementy sygnału w regionie promotora.
Ponadto w eukariotach regiony promujące są bardziej rozpowszechnione. Istnieją różne sekwencje, znajdujące się w regionie -30 i -100, które ustanawiają różne kombinacje w różnych promotorach.
W eukariotach istnieje wiele czynników transkrypcyjnych, które wchodzą w interakcje z promotorami. Na przykład czynnik TFIID wiąże się z sekwencją TATA. Z drugiej strony geny rybosomalne RNA są ustrukturyzowane w postaci wielu genów, a następnie drugi.
Zmiany sekwencji konsensusowych regionów -10 i -35 zmieniają związek polimerazy RNA w regionie promotora. Zatem mutacja pojedynczej zasady powoduje spadek prędkości związkowej RNA polimerazy do regionu promotora.
Funkcje
Papier transkrypcyjny
Pudełko TATA uczestniczy w związku i inicjacji transkrypcji. W I. coli, Polimeraza RNA holoenzymu składa się z pięciu podjednostek α2ββσ. Podjednostka σ dołącza do podwójnego łańcucha DNA i porusza się w poszukiwaniu skrzynki Tata, co jest sygnałem wskazanym na początku genu.
Jak odbywa się transkrypcja?
Podjednostka σ polimerazy RNA ma bardzo wysoką stałą powiązania z promotorem (w kolejności 10jedenaście), co wskazuje na wysoką specyficzność rozpoznawania między nim a sekwencją pola PriBiBiew.
Może ci służyć: Komórki Langerhans: Charakterystyka, morfologia, funkcjePolimeraza RNA dołącza do promotora i tworzy zamknięty kompleks. Następnie tworzy otwarty kompleks, który charakteryzuje się lokalnym otwarciem 10 par zasad podwójnego śmigła DNA. To otwarcie jest ułatwione, ponieważ sekwencja pola PriBiew jest bogata w A-T.
Po rozwinieniu DNA, powstaje pierwszy łącze fosfodiéster i zaczyna się eliminacja RNA. Podjednostka σ jest uwalniana, a polimeraza RNA porzuca promotor. Inne cząsteczki polimerazy RNA mogą dołączyć do promotora i rozpocząć transkrypcję. W ten sposób gen można przepisać wiele razy.
U drożdży polimeraza RNA II składa się z 12 podjednostek. Enzym ten rozpoczyna transkrypcję rozpoznając dwa typy sekwencji konsensusowych na 5ʾ końcu początku transkrypcji, a mianowicie: tata konsensus; Sekwencja konsensusu CAAT.
Czynniki transkrypcyjne
Polimeraza RNA II potrzebuje białka, zwanych czynnikami transkrypcyjnymi TFII, w celu utworzenia aktywnego kompleksu transkrypcyjnego. Czynniki te są dość zachowane we wszystkich eukariotach.
Czynniki transkrypcyjne są cząsteczkami natury białkowej, które mogą dołączyć do cząsteczki DNA i zdolność do zwiększenia, zmniejszenia lub anulowania produkcji określonego genu. To wydarzenie ma kluczowe znaczenie dla regulacji genów.
Tworzenie kompleksu transkrypcyjnego zaczyna się od wiązania białka TBP („białko wiążące TATA”) z tata caja. Z kolei białko to wiąże TFIIB, który również wiąże się z DNA. Kompleks TBP-TFIIB łączy się z innym kompleksem utworzonym przez TFIIF i RNA polimerazy II. W ten sposób TFIIF pomaga polimerazie RNA II dołączyć do promotora.
Może ci służyć: lenticelaW końcu Tfiie i TFIIH dołączają i utworzą zamknięty kompleks. TFIIH jest helosa i promuje oddzielenie podwójnego łańcucha DNA, proces, którego potrzebuje ATP. Dzieje się tak w pobliżu początku syntezy RNA. W ten sposób powstaje otwarty kompleks.
Czynniki transkrypcyjne i rak
Białko p53 jest czynnikiem transkrypcyjnym, znanym również jako białko supresorowe nowotworu p53. Jest to produkt dominującego raka. Zespół Li-Francoi jest wytwarzany przez kopię tego zmutowanego genu, który powoduje pojawienie się raków, białaczki i guzów.
Wiadomo, że p53 hamuje transkrypcję niektórych genów i aktywuje transkrypcję innych. Na przykład p53 zapobiega transkrypcji genów z promotorem TATA poprzez tworzenie kompleksu utworzonego przez p53, inne czynniki transkrypcyjne i promotor TATA. Zatem p53 utrzymuje wzrost komórek pod kontrolą.
Bibliografia
- Bohinski, r. 1991. Biochemia. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, s. 1., Baltimore, zm., Darnell, J. 2003. Biologia komórkowa i molekularna. Pan -american Medical Redaktorial, Buenos Aires.
- Przyjaciele. 1994. P53: Rzut oka na marionetkę za grę Shadow. Science, 265: 334.
- Devlin, t.M. 2000. Biochemia. Redakcja Reverté, Barcelona.
- Voet, d., Voet, J. 2004. Biochemia. Jonh Wiley and Sons, Nowy Jork.
- Nelson, zm. L., Cox, m. M. 2008. Lehninger-Principles of Biochemistry. W.H. Freeman, Nowy Jork.
- « Osteoklasty trening, cechy, funkcje, choroby
- Porfiromonas gingivalis Charakterystyka, morfologia, cykl życia »

