Historia kadmu (CD), właściwości, struktura, zastosowania

- 2743
- 45
- Eliasz Dubiel
On kadm (CD) to przejściowy metal po przejrzeniu liczby atomowej 48 i srebrnego koloru. Jest plastyczny i plastyczny, z stosunkowo niskimi punktami topnienia i wrzenia. Kadm jest rzadkim pierwiastkiem i ma zaledwie stężenie 0,2 g / tonę skorupy ziemskiej.
La Greenockita (CDS) jest jedyną ważną Mena kadmu, która przedstawia intensywne żółte zabarwienie. Kadm jest związany z cynkiem w sfalerycie (ZNS), który zawiera od 0,1 do 03 % kadmu jako kation CD2+.
 Kryształy kadmu. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]
Kryształy kadmu. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Podczas przetwarzania sfannel w celu uzyskania, odlewni i rafinacji cynku kadm uzyskuje się wtórnie, a jest to głównym źródłem produkcji.
Ten metal został odkryty w 1817 roku, niezależnie przez Friedricha Stromayera i Karla Hermanna. Stromayer ochrzcił nowy element o nazwie kadmu, powstał od łacińskiego słowa „kadmia”, termin jako kalamina (węglan cynku) był znany (węglan cynku).
 Kadm jest elementem chemicznym z symbolem CD, a jego liczba atomowa wynosi 48. Źródło: Albedo-Ukr CC BY-SA 2.5 (http: // creativeCommons.ORG/Licencje/BY-SA/2.5/)
Kadm jest elementem chemicznym z symbolem CD, a jego liczba atomowa wynosi 48. Źródło: Albedo-Ukr CC BY-SA 2.5 (http: // creativeCommons.ORG/Licencje/BY-SA/2.5/) Kadm jest elementem doskonałej użyteczności i licznych zastosowań, takich jak metale przeciwkołumowe, stalowe i nieżelazne; używać jako pigmentu; Stabilizacja PVC; Element w stopach używanych w spoinach; Akumulatory niklu-kadmowe ładowane itp.
Jest to jednak bardzo toksyczny element, który powoduje poważne uszkodzenie płuc, nerek i kości, a nawet czynność rakotwórcza została wskazana, dlatego jego stosowanie zostało ograniczone. Mimo to w niektórych aplikacjach nadal jest starannie używany.
[TOC]
Historia
- Podwójne odkrycie
Kadm został odkryty przez Friedrich Stromayer, niemiecki chemik, w 1817 r. W próbce węglanowej cynku (Calamina). W tym samym roku K. S. L. Hermann i J. C. H. Roloff dokonał tego samego odkrycia, niezależnie, w eksperymencie przeprowadzonym z siarczkiem cynku.
Zwrócono uwagę, że Stromayer dokonał odkrycia podczas wypełnienia wniosku rządowego w celu sprawdzenia apteki miasta Hildesheim w Niemczech. W leczeniu niektórych warunków skóry zastosowano tlenek cynku.
Wygląda na to, że apteki nie wydawały tlenku cynku, ale zamiast tego sprzedały węglan cynku: surowiec do produkcji tlenku cynku. Producenci tlenku cynku argumentowali, że węglan cynku ogrzewany był żółty „tlenek cynku”.
Tlenek kadmu
Nie mogli sprzedać tego „tlenku cynku”, ponieważ kolor związku był zwykle biały; I zamiast tego sprzedali węglan cynku, a także biały. Biorąc pod uwagę tę sytuację, Stromayer postanowił zbadać domniemany żółty tlenek cynku.
Aby to zrobić, rozgrzał próbki węglanu cynku (kalamina), a poinformowano żółty tlenek cynku. Po przeanalizowaniu doszedł do wniosku, że żółty kolor był produktem ze względu na obecność metalicznego tlenku nowego elementu.
Po wydobyciu tego nowego metalicznego tlenku, spowodował jego redukcję, osiągając izolację kadmu. Stromayer określił swoją gęstość i uzyskał wartość 8,75 g/cm3, blisko wartości znanej obecnie z tego parametru (8,65 g/cm3).
Podobnie Stromayer wskazał, że nowy element miał wygląd podobny do Platinum i że był również obecny w wielu związkach cynku i obejmuje w oczyszczonym cynku.
Stromayer zasugerował nazwę „kadmu” od łacińskiego głosu „kadmia”, nazywana Calamina, Znco3.
Kadm w siarczku cynku
Karl Hermann (1817) znalazł niestały żółty kolor, gdy przetworzył siarczek cynkowy i pomyślał, że może to być zanieczyszczenie arsenem. Ale kiedy ta możliwość została odrzucona, Hermann zdał sobie sprawę, że był w obecności nowego elementu.
- Aplikacje
1840-1940
W latach 40. XIX wieku użycie kadmu zaczęło być wykorzystywane jako pigment. Brytyjski kodeks farmaceutyczny wskazuje w 1907 r.
W latach 30. i 40. XX wieku produkcja kadmu była przeznaczona do platyny stali i żelaza, aby chronić je przed korozją. W latach pięćdziesiątych zastosowano związki kadmu, takie jak siarczk kadmowy i selenid kadmu, jako źródła czerwonego, pomarańczowego i żółtego.
1970-1990
W latach siedemdziesiątych i 80. XX wieku odkryto, że związki kadmu kadmu i stearynian były stabilizatorami PVC, co spowodowało wzrost popytu na kadm. Jednak przepisy środowiskowe z powodu toksyczności kadmu.
W latach 80. i 90. kadm przestał stosować wiele swoich zastosowań, ale potem jego produkcja wzrosła wraz z tworzeniem akumulatorów niklu-kadm, które stały się 80 % zużycia kadmu w Stanach Zjednoczonych.
Może ci służyć: zastosowania i zastosowania AlceanówWłaściwości fizyczne i chemiczne kadmu
Wygląd
Silny i miękki szary -biel. Staje się krucha przez ekspozycję na 80 ° C, będąc w stanie wyciąć nożem. Jest plastyczny i można utworzyć z nim bułki.
Standardowa masa atomowa
112 414 u
Liczba atomowa (z)
48
Kategoria elementów
Metal po -transition, na przemian rozważany metal przejściowy. Definicja IUPAC metalu przejściowego jest taka, której atomy mają niepełny podkap.
Zgodnie z tą definicją kadm nie jest metalem przejściowym od czasu jego kationu CD2+ Ma swoje orbitale 4D całkowicie pełne elektronów (4d10).
Zapach
Toaleta
Temperatura topnienia
321,07 ºC
Punkt wrzenia
767 ° C
Gęstość
Temperatura otoczenia: 8,65 g/cm3
W punkcie topnienia (ciecz): 7996 g/cm3
Fusion Heat
6,21 kJ/mol
Ciepło parowe
99,87 kJ/mol
Pojemność kaloryczna trzonowa
26 020 J/(mol · k)
Elektronialiczność
1.6 na skali Pauling
Energie jonizacyjne
Po pierwsze: 867,8 kJ/mol (CD+ gazowy)
Po drugie: 1631,4 kJ/mol (CD2+ gazowy)
Po trzecie: 3616 kJ/mol (CD3+ gazowy)
Przewodność cieplna
96,6 W/(M · K)
Oporność Elektryczny
72,7 nω · m w 22 ° C
Twardość
2.0 w skali MOHS. Jest to metal, choć gęsty, znacznie miękki.
Stabilność
Jest powoli utleniony przez mokre powietrze, tworząc tlenek kadmu, który niszczy jego metaliczną jasność. Nie jest łatwopalny, ale w postaci pyłu może spalić i doświadczać samozapysania.
Samokierunek
250 ° C dla kadmu jest postacią kurzu.
Współczynnik załamania światła
1,8 do 20 ° C
Reaktywność
Kadm może spalić w powietrzu, tworząc tlenek kadmu (CAO), brązowy amorficzny kurz, podczas gdy krystaliczny kształt jest ciemnoczerwony.
Kadm szybko reaguje z rozcieńczonym kwasem azotowym i powoli z gorącym kwasem solnym. Jest także w stanie reagować z kwasem siarkowym, ale nie reaguje z alkaliami. We wszystkich tych reakcjach powstają sole kadmowe odpowiadających im anionów (Cl-) lub oksoaniony (nie3- A więc42-).
Struktura elektroniczna i konfiguracja
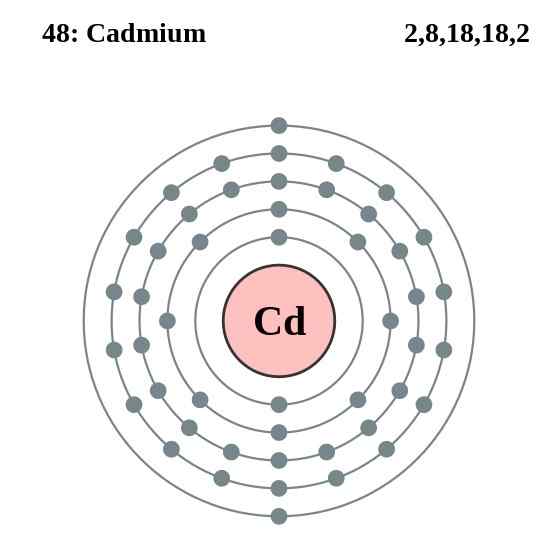 Schemat warstwy elektronów kadmu, element 48 w stoliku okresowym. Źródło: Pumbaa (oryginalna praca Greg Robson) CC BY-SA 2.0 (http: // creativeCommons.ORG/Licencje/BY-SA/2.0/)
Schemat warstwy elektronów kadmu, element 48 w stoliku okresowym. Źródło: Pumbaa (oryginalna praca Greg Robson) CC BY-SA 2.0 (http: // creativeCommons.ORG/Licencje/BY-SA/2.0/) Atomy kadmu ich szkła ustanawiają wiązanie metalowe z ich walencyjnych elektronów, które znajdują się na orbitalach 4D i 5S zgodnie z ich konfiguracją elektroniczną:
[Kr] 4d10 5s2
Jednak chociaż orbitale 4D są pełne elektronów i że można również uznać, że „morze elektronów” jest obfite, aby silnie przyczynić się do atomów CD, w rzeczywistości interakcje są słabe. Można to wykazać eksperymentalnie z niską temperaturą topnienia (321 ° C), w porównaniu z innymi metaliami przejściowymi.
Dlatego i inne przyczyny chemiczne kadm nie jest czasem uważany za metal przejściowy. W ich wiązaniu metalowym jest tak wiele elektronów (dwunastu), które zaczynają zakłócać ich negatywne odpychanie; który wraz z różnicą energii między orbitalem 4D pełnym a 5S osłabia interakcję CD-CD.
Atomy CD definiują zwartą sześciokątną strukturę krystaliczną (HCP), która nie cierpi przejścia fazowych przed jego temperaturą topnienia. Gdy kryształy HCP kadmu ulegają ciśnieniu równoważnym 10 GPa, struktura jest tylko deformami; Ale bez zgłaszania jakiejkolwiek zmiany fazowej.
Liczby utleniania
Kadm nie może stracić dwunastu elektronów Walencji; W rzeczywistości nie można nawet stracić jednego z jego orbitali 4D, bardziej stabilnych energii w porównaniu z orbitalami 5s. Dlatego możesz stracić tylko dwa elektrony orbitalne 5s2, w konsekwencji bojowy metal; Podobnie jak w przypadku cynku, rtęci i metali alkalicznych (MR. Scholambara).
Gdy w jego związkach zakłada się istnienie kationu CD2+, Następnie mówi się, że kadm ma numer utleniania +2 lub stan. To jest jego główny numer utleniania. Na przykład następujące związki zawierają kadm jako +2: CDO (CD2+ALBO2-), Cdcl2 (PŁYTA CD2+Cl2-), CDSO4 (PŁYTA CD2+południowy zachód42-) i CD (nie3)2.
Oprócz tego numeru utleniania występuje również +1 (CD+) i -2 (CD2-). Numer utleniania +1 obserwuje się w CD22+, w którym każdy atom kadmu ma obciążenie dodatnie. Tymczasem -2 jest dość dziwne i ubiegałoby się o anion „kadmuro”.
Gdzie to jest i uzyskaj
 Kryształy Greenockita. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Kryształy Greenockita. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Kadm jest rzadkim elementem, który ma stężenie 0,2 g / tonę skorupy ziemskiej. Jedynym ważnym minerałem kadmu jest Greenockita (CDS), który nie jest wykorzystywany z górnictwa i komercyjnego punktu widzenia.
Może ci służyć: Flokulacja: reakcja, typy, zastosowania, przykładyKadm jest związany z cynkiem w minerałach skutkowych (ZNS), który zwykle zawiera stężenie, które waha się od 0,1 % do 0,3 %; Ale w niektórych przypadkach stężenie kadmu w sfalerycie może osiągnąć 1,4 %.
Przetworzone skały w celu uzyskania nawozów fosforu mogą mieć stężenie kadmu 300 mg / kg nawozu. Węgiel może również zawierać małe, ale znaczne ilości kadmu.
Ważnym źródłem kadmu są emisje wulkaniczne, które mogą doprowadzić kadm do wód powierzchniowych. Zastosowanie nawozów fosforu w glebie stosowania rolnictwa doprowadziło do zanieczyszczenia kadm.
Kadm obecny w gleb kwaśnych jest wchłaniany przez warzywa. Niektóre warzywa są wykorzystywane przez człowieka jako żywność, co wyjaśnia, w jaki sposób spożycie wody i pokarmu jest głównym źródłem dochodów kadmu u osób bezspresowych lub palenia.
Leczenie sfaletowe
Podczas wydobycia, wytopu i rafinacji cynku obecnego w sfaleryt, kadm jest zwykle uzyskiwany jako produkt wtórny. Występuje również podobne zdarzenie, choć do znacznie mniejszego stopnia, podczas przetwarzania miedzi i ołowiu.
Podobnie niewielkie ilości kadmu można uzyskać z recyklingu odpadów żelaza i stalowego.
Rozklęta jest poddawana tostom, tak że siarczek cynku stał się jego tlenek, ZnO. Ta sama reakcja cierpi z powodu siarczku kadmu:
2 Zns + 3 O2 → 2 ZnO + 2 SO2
Jeśli ta mieszanka tlenku zostanie podgrzewana węglem, zostaną one zredukowane do odpowiednich metali:
ZnO + CO → Zn + CO2
Podobnie cynk i kadm mogą być wytwarzane przez elektrolizę podczas rozpuszczania tlenków w kwasie siarkowym.
Każda z dwóch metod generuje pięćdziesiąt zanieczyszczonych kadmem. Podczas topnienia kadm można destylować w próżni ze względu na jego niższą temperaturę topnienia (321 ° C) w porównaniu do tego z CINC (420 ° C).
Izotopy
Wśród naturalnych i stabilnych izotopów kadmu, z ich odpowiednimi obfitościami tutaj na Ziemi:
-106CD (1,25%)
-108CD (0.89%)
-110CD (12,47%)
-111CD (12,8%)
-112CD (24,11%)
-114CD (28,75%)
-113CD (12,23%)
On 113CD jest radioaktywna, ale ze względu na wielką wartość swojego pół -life (T1/2= 7,7 · 10piętnaście lata), można uznać za stabilne. A potem jest 116CD, również radioaktywne, z pół -literem wynoszącym 3,1,1019 lata, więc można go uznać za stabilny izotop, co stanowi 7,51 % kadmu.
Zauważ, że średnia masa atomowa wynosi 112 414 u, bliżej 112 niż 114. Istnienie dominującego izotopu powyżej innych nie jest obserwowane w kadmie.
Ryzyko
Ogólny
Absorpcja kadmu występuje głównie przez jedzenie, zwłaszcza wątrobę, grzyby, skorupiaki, sproszkowane kakao i suche glony.
W ubiegłym stuleciu wystąpił symboliczny przypadek w Chinach, gdzie w populacji nastąpiło ważne zanieczyszczenie z kadmem. Zanieczyszczenie kadmu było spowodowane jego wysokim stężeniem w ryżu, spowodowanym obecnością kadmu w glebach uprawy zbożowej.
Palacz ma średnio 60 µg / dzień. Maksymalne stężenie kadmu dozwolone we krwi wynosi 15 µg / dzień. Nie palacze mają stężenie kadmu we krwi około 0,5 µg / l.
Płuca pochłaniają od 40 do 60 % kadmu obecnego w dymie tytoniowym. Kadm wchłaniany w płucach jest transportowany we krwi, tworząc kompleksy z białkami, cysteiną i glagacją, które następnie kończą się w wątrobie, nerkach itp.
Ostre inhalacja kadmu może powodować objawy podobne do obserwowanych w procesie grypy; takie jak zimno, gorączka i bóle mięśni, możliwość spowodowania uszkodzenia płuc. Tymczasem przewlekłe narażenie na kadm może powodować choroby płuc, nerki i kości.
Wpływ na nerki
W nerkach kadm zwykle powoduje zmianę fosforu i metabolizmu wapnia, o czym świadczy wzrost obliczeń nerek. Ponadto powoduje uszkodzenie nerek objawiające się w wyglądzie w moczu białka przenośnika retinolu i β-2-mikroglobuliny.
Efekt reprodukcji
Ekspozycja matki na kadm jest związana z niską masą dziecka po urodzeniu i wzrostem wskaźnika spontanicznych aborcji.
Uszkodzenie kości
Kadm jest powiązany w Japonii z obecnością choroby Itai -itai w ostatnim stuleciu. Ta choroba charakteryzuje się niską mineralizacją kości, kruchością kości z wysokim wskaźnikiem pękania, zwiększoną osteoporozą i bólem kości.
Może Ci służyć: CD3: Charakterystyka, funkcjeRakotwórczość
Chociaż eksperymenty szczurów ustaliły związek między kadmem a rakiem prostaty, nie zostało to wykazane u ludzi. Odeponano związek między kadmem a rakiem nerek, a także powiązany z rakiem płuc.
Aplikacje
Bakterie do ładowania niklu-kadm
 Różne baterie lub akumulatory NI-CD. Źródło: Boffy B przez Wikipedia.
Różne baterie lub akumulatory NI-CD. Źródło: Boffy B przez Wikipedia. Wodorotlenek kadmu zastosowano jako katodę w akumulatorach NI-CD. Zastosowano je w przemyśle kolejowym i lotniczym, a także w instrumentach do zbiorowego użytku, które obejmują telefony komórkowe, kamera, laptopy itp.
Zużycie kadmu do opracowania akumulatorów NI-CD stanowi 80 % produkcji kadmu. Jednak z powodu toksyczności tego elementu akumulatory NI-CD były stopniowo zastępowane przez akumulatory wodorków niklu.
Pigmenty
 Kadm czerwony. Źródło: Marco Almbauer [domena publiczna]
Kadm czerwony. Źródło: Marco Almbauer [domena publiczna] Siarczek kadmu jest stosowany jako żółty pigment i kadm seleniuro jako czerwony pigment, znany jako Cadmio Red. Pigmenty te charakteryzują się ich blaskiem i intensywnością, więc były one używane w tworzyw sztucznych, ceramice, szkła, emalii i kolorach artystycznych.
Wskazano, że malarz Vincent van Gogh używał pigmentów kadmu w swoich obrazach, co pozwoliło mu osiągnąć różnorodne czerwone, pomarańczowe i jasnożółte.
Zabarwienie pigmentów kadmowych musi być osłabione przed uziem.
Telewizja
Komponenty zawierające kadm zastosowano w fosforach czarno -białych telewizorów, a także w niebiesko -zielonych meczach dla kolorowych lamp obrazów telewizyjnych.
Fosfor był częścią ekranu, który był promieniowany przez promienie katodowe, odpowiedzialne za tworzenie obrazu. Kadm, pomimo swojej toksyczności, zaczął być stosowany w telewizorach Qled of Ostatnie.
Stabilizacja PVC
Związki kadmu utworzone z karboksylanu, laureracji i steereatu zastosowano jako stabilizatory chlorkowe winylu, ponieważ opóźniają degradację wytwarzaną przez ekspozycję na ciepło i światło ultrafioletowe, które rozkłada PVC podczas jego procesu produkcyjnego.
Ze względu na toksyczność kadmu ponownie stabilizatory PVC zjednoczone z kadmem zostały zastąpione innymi stabilizatorami, takimi jak bar barowy, wapń-zink i organostaño.
Stopy
Kadm był stosowany w stopach noszących ze względu na jego wysoką odporność na zmęczenie i współczynnik niskiego tarcia. Kadm ma stosunkowo niską temperaturę topnienia, więc jest stosowany w stopach o niskiej uzysku i jest składnikiem oprócz wielu rodzajów spawania.
Kadm może być również stosowany w stopach przewodności elektrycznej, przewodności cieplnej i styku elektrycznego.
Pokrycie
Kadm jest stosowany do ochrony stali, aluminium i innych nieżelaznych elementów mocowania metalu, a także części mobilnych. Powłoka kadmu dostarcza ochronę korozji w tych soli fizjologicznej i alkalicznej. Ponadto służy jako smar.
Kadm jest również stosowany w wielu zastosowaniach elektrycznych i elektronicznych, które wymagają oporności na korozję i niskiej oporności elektrycznej.
Reaktor nuklearny
Kadm jest stosowany w reaktorach jądrowych ze względu na ich zdolność do przechwytywania neutronów, co pozwala kontrolować nadmiar neutronów Produkt rozszczepienia jądrowego, unikając dodatkowych szczelin jądrowych.
Półprzewodniki
Seleniuro i kadm telluiuro są związkami, które wypełniają funkcję półprzewodników w wykrywaniu światła i ogniw słonecznych. HGCDTE jest wrażliwy na światło podczerwieni i jest używane jako detektor ruchu, a także przełącznik dla urządzeń zdalnych.
biologia
 Światło laserowe He-CD. Źródło: raczej anonimowy (https: // www.Flickr.com/zdjęcia/[e -mail chroni]/35766549)
Światło laserowe He-CD. Źródło: raczej anonimowy (https: // www.Flickr.com/zdjęcia/[e -mail chroni]/35766549) Hel-CD interweniuje w tworzeniu niebiesko-fioletowej wiązki laserowej o długości fali, która waha się między 325 a 422 nm, użyteczną w mikroskopach fluorescencyjnych.
Kadm jest stosowany w biologii molekularnej do blokowania kanałów wapnia, zależnego od potencjału błony.
Bibliografia
- Wikipedia. (2019). Kadm. Źródło: w:.Wikipedia.org
- Dżungla v. R. I i in. (2014). Struktura wysokiego ciśnienia i temperatury ciekłego i stałego CD: implikacje dla krzywej topnienia CD. Odzyskane z: badań.internet
- Dr. Ciasto Stewart. (2019). Fakty elementów kadmu. Odzyskane z: Chemicool.com
- National Center for Biotechnology Information. (2019). Kadm. Baza danych Pubchem. CID = 23973. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Godt, J., Scheidig, f., Grosse-sestup, c., Esche, v., Brandenburg, s. 1., Reich, a., & Groneberg, D. DO. (2006). Toksyczność kadmu i wynikające z tego zagrożenia dla zdrowia ludzi. Journal of Judne Medicine and Toxicology (Londyn, Anglia), 1, 22. Doi: 10.1186/1745-6673-1-22
- Ros Rachel. (30 lipca 2018 r.). Fakty o Camium. Odzyskane z: Livescience.com
- Redaktorzy Enyclopaedia Britannica. (6 września 2018 r.). Kadm. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Międzynarodowe Stowarzyszenie Kadmu. (S.F.). Zastosowania kadmu. Odzyskane z: kadm.org
- Lentech b. V. (2019). Kadm. Odzyskane z: lentech.com
- « Funkcje węzłów podstawowych, anatomii i patologii
- Historia Parasitology, What You Stuwy?, gałęzie, koncepcje »

