Bromotimol Blue

- 4033
- 399
- Bertrand Zawadzki
 Bromotimol Blue to wskaźnik pH. Źródło: Wikimedia Commons
Bromotimol Blue to wskaźnik pH. Źródło: Wikimedia Commons Co to jest Bromotimol Blue?
On Bromotimol Blue Jest pochodną trifenylometano, która służy jako wskaźnik pH. Wskaźnik to organiczny bark, którego kolor zależy od stężenia jonu H3ALBO+ lub średniego pH. Ze względu na kolor, który wykazuje, wskaźnik może wskazywać na kwasowość lub zasadowość roztworu.
Bromotimol Blue ma aktywną skalę wskazania między pH 6.0 i 7.6. Do pH medium mniej niż 6.5 (kwas) manifestuje żółte zabarwienie. Gdy średnie pH zmienia się między 6.5 i 7.6 (neutralny), nabywa zielone zabarwienie. PH większy niż 7.6 Jego kolor jest niebieski (podstawowy).
Ta funkcja nadaje mu doskonałą użyteczność, ponieważ można ją stosować w skali pH zbliżonej do neutralności, dokładnie tam, gdzie występują procesy fizjologiczne.
Jonizacja niebieska bromotimol w roztworze wodnym można schematyzować w następujący sposób:
Hin (żółty) +h₂o w- (niebieski kolor) + h3ALBO+
Gdy wskaźnik jest protonowany (HIN) nabywa żółte zabarwienie; Podczas gdy wskaźnik jest bezbronny (w-) Kolorowanki jest niebieski.
Struktura chemiczna
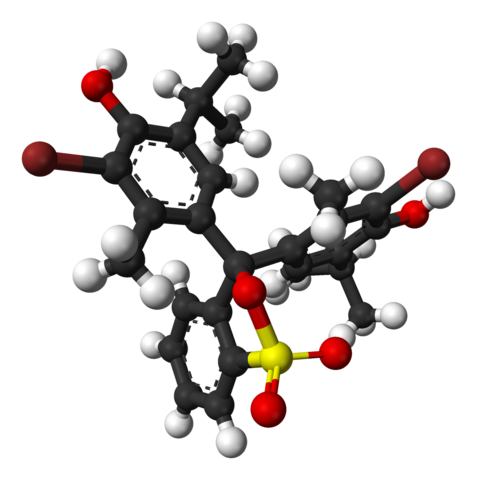 Struktura chemiczna Bromotimol Blue. Źródło: Wikimedia Commons
Struktura chemiczna Bromotimol Blue. Źródło: Wikimedia Commons Na górnym obrazie struktura niebieskiego bromotimol jest reprezentowana za pomocą modelu baru i kule do pH mniej niż 7.1. Brązowe słupki odpowiadają atomom bromu, łącznie dwa.
Każdy z trzech pierścieni aromatycznych komponuje się, obok grup metylowych, CH3, I termiczne, grupa Timol i połączenie BR, stamtąd powód nazywa się „bromotimol”.
Może ci służyć: wodorotlenkiW dolnej części pokazano grupę sulfonianową, R-TO3-, Z czerwonymi kulkami i żółtą. Tę grupę można połączyć przez atom lub węgiel centralny, który łączy się z trzema pierścieniami aromatycznymi.
Zmiany pH
Ta struktura molekularna, chociaż nie zmienia się radykalnie z kwaśnym lub podstawowym pH, zmienia swoje stany elektroniczne, odzwierciedlone przez zmiany kolorów roztworów.
Poniżej pH 7 wskaźnik jest żółty i przyjmuje strukturę obrazu, ale jeśli pH staje się podstawowe, grupy -OH są niefortunne i można uformować podwójne wiązanie c = o.
W rezultacie sprzężony układ cząsteczki (wszystkich jej podwójnych wiązań rezonansowych) zmienia się wystarczająco, aby elektrony nie wchłaniały tych samych fotonów, a roztwór staje się od żółtego do niebieskawy.
Jeśli z drugiej strony pH jest znacznie poniżej 7, kolor wskaźnika zmienia się z żółtego na czerwony. Tutaj zmiana w systemie sprzężonym jest spowodowana protonacją grup -OH a -OH2+. -
Zarówno w pożywce kwaśnej, jak i podstawowej cząsteczka traci stabilność, pochłania mniejsze fotony, aby umożliwić przejścia elektroniczne odpowiedzialne za kolory postrzegane przez widzów.
Kolor zielony zaobserwowany na głównym obrazie wynika z następujących czynności.1, niewielka część cząsteczek traci protony, pożegnając się z niebieskim kolorem, który miesza się z żółtym, nadaje zielony kolor.
Właściwości dBromootimol Blue
Nazwa chemiczna
Bromotimol niebieski lub 3.3'-dibromotimolsulfonfet.
Formuła molekularna
C27H28Br2ALBO5S.
Waga molekularna
624.384 g/mol.
Wygląd fizyczny
Pył solidnego koloru w zakresie różu i fioletu.
Może ci służyć: Butanal: Struktura, właściwości, zastosowania i ryzykoChemiczna charakterystyka
Działa jak słaby kwas w roztworze. Gdy jest protonowany w kwaśnym pożywce, nabiera żółtego koloru, neutralne pH jest zielone, a gdy jest nieprzyjemny w alkalicznym pH.
Stała dysocjacji jonowej (KA)
7.9 x 10-8.
Aktywny zakres wskazania
PH 6.0 do 7.6. Wynika to z obecności atomów bromu, które działają poprzez ekstrakcję elektronów i dwóch umiarkowanych grup dawców elektronów (podstawniki alkilowe).
Gęstość
1.25 g/cm3.
Temperatura topnienia
202 ° C (396 ° F).
Punkt wrzenia
184.9 ° C.
Rozpuszczalność
Jest prawie rozpuszczalny w wodzie i oleju. Jest również niewiele rozpuszczalny w rozpuszczalnikach niezarodowych, takich jak benzen, toluen i ksylen, i praktycznie nierozpuszczalny w eterze olejowym. Jest rozpuszczalny w wodnych roztworach alkalis i alkoholu.
Stabilność
Jest stabilny w temperaturze otoczenia i niezgodny z silnymi środkami utleniającymi.
Absorpcja światła
Protonowany kształt ma swoją maksymalną absorpcję przy długości fali (λ) 427 nm, przesyłając w ten sposób żółte światło w roztworach kwasowych, a niechrotny kształt ma maksymalną absorpcję przy długości fali (λ) 602 nm, przenosząc światło jasnoniebieskie do Alkaliczne pH.
Zastosowania i aplikacje
W badaniach metabolicznych
Bromotimol Blue jest stosowany w wielu procesach, w których wytwarzany jest dwutlenek węgla (CO₂), z wynikającym z tego generowaniem kwasu węglowego (H (H H2WSPÓŁ3), który zakwasza pożywkę, o której świadczy zmiana kolorowania niebieskiego bromotimolowego.
Jeśli dana osoba wykonuje ćwiczenie fizyczne i jest podłączona do rurki, która z kolei jest w połączeniu z pojemnikiem z roztworem błękitu bromotimolowego, zaobserwowano następujące zjawisko: w wyniku wzrostu aktywności fizycznej i Metabolizm, nastąpi wzrost produkcji CO₂.
Może ci służyć: krzem: historia, właściwości, struktura, uzyskiwanie, użyciaCO₂ zareaguje z wodą, wytwarzając kwas węglowy, h2WSPÓŁ3, który później oddziela uwalnianie jonu h+ i zakwaszenie pożywki. Powoduje to, że Bromotimol Blue nabywa żółte zabarwienie, podkreślając kwasowość środowiska.
W położnictwie
Bromotimol Blue jest używany w położnictwie do pokazania wczesnego pęknięcia błon. Płyn owodniowy zwykle ma pH większy niż 7.7, więc Bromotimol Blue będzie kolor niebieski, gdy zostanie w kontakcie z płynem, który ucieka.
PH pochwy jest zwykle kwaśne, więc Bromotimol Blue ma żółte zabarwienie. Zmiana jego koloru na niebieskie przejawia obecność płynu owodniowego w obszarze pochwy.
Inne zastosowania
Bromotimol Blue ma również zastosowanie w następującym sprzęcie i funkcjach:
- Czujniki optyczne
- Systemy wykrywania spalania gazowego
- W opracowaniu obrazów, zabawek, czyszczenia produktów, detergentów i tkanin
- Czujniki świeżości żywności
- Jako identyfikator świeżego ryżu i zjełczały
- W wykrywaniu mikroorganizmów.
Jest również stosowany w analizie wzrostu bakteryjnego, leków psychoaktywnych i materiałów dentystycznych.
Przygotowanie
100 mg błękitu bromotimolowego rozpuszczane jest w 100 ml rozcieńczonego alkoholu i w razie potrzeby filtruje. Jest również przygotowywany w następujący sposób: 50 mg błękitu bromotimolowego rozpuszczane jest w mieszaninie 4 ml 0,02 N wodorotlenku sodu i 20 ml alkoholu, wykonując 100 ml z wodą z wodą z wodą.
Bibliografia
- Foist l. Bromothymol Blue: Definicja, zastosowania i formuła. Badanie odzyskało.com
- Bromotymolowy wskaźnik pH, 1 uncja. Odzyskany z Sciencecompany.com
- Spektrofotometryczne oznaczanie PK wskaźnika niebieskiego bromotymolu. Odzyskane z FCH.UPOL.CZ

