Historia siarki, właściwości, struktura, uzyskiwanie, zastosowania

- 3598
- 990
- Pani Gilbert Stolarczyk
On siarka Jest to element niemetaliczny, który prowadzi, poniżej tlenu, grupa calcogenów w tabeli okresowej. Znajduje się specjalnie położony w grupie 16 z okresem 3 i jest reprezentowany z symbolem chemicznym. Jego naturalnych izotopów, 32S śpi dużo (około 94% wszystkich atomów siarki).
Jest to jeden z najliczniejszych elementów na Ziemi, składającym około 3% całkowitej masy. To znaczy, że jeśli zabrano całą siarkę planety, można zbudować dwa żółte księżyce; zamiast jednego byłyby trzy satelity. Może przyjąć kilka stanów utleniania (+2, -2, +4 i +6), więc ich sole są liczne i wzbogacają kory lądowe i jądro.
 Kryształy siarki. Źródło: Pixabay.
Kryształy siarki. Źródło: Pixabay. Siarka jest synonimem żółtych, nieśmiałych zapachów i piekła. Głównym powodem jego złych zapachów są jego pochodne związki; szczególnie gazowy i organiczny. Reszty ich minerały są solidne i mają kolory, które obejmują żółty, szary, czarny i biały (między innymi).
Jest to jeden z elementów, który najbardziej przedstawia szeroką liczbę wylotów. Można go znaleźć jako małe i dyskretne cząsteczki s2 lub s3; jako pierścienie lub cykle, bycie ortorombowym i monoklinicznym siarką8 najbardziej stabilny i obfity ze wszystkich; i jako helikalne łańcuchy.
Nie tylko znajduje się w krze ziemi w postaci minerałów, ale także w matrycach biologicznych naszego ciała. Na przykład w aminokwasach cystyn, cysteiny i metioniny, w białkach żelaza, keratyny i witamin. Jest również obecny w czosnku, grejpfrutach, cebuli, kapusty, brokułach i kalafiorach.
Chemicznie jest to miękki element, a przy braku tlenu tworzy minerały i siarczany siarki. Oparza niebieskawym płomieniem i może być pokazany jako amorficzna lub krystaliczna stała stała.
Pomimo tego, że jest niezbędny do syntezy kwasu siarkowego, wysoce żrący substancji i przyznawania nieprzyjemnych zapachów, w rzeczywistości jest to łagodny element. Siarka może być przechowywana w dowolnej przestrzeni bez głównych środków ostrożności, o ile unika się pożarów.
[TOC]
Historia siarki
W Biblii
Siarka jest jednym z najstarszych elementów w historii ludzkości; Tak bardzo, że jego odkrycie jest niepewne i nie wiadomo, który ze starożytnych cywilizacji użył go po raz pierwszy (4000 lat przed Chrystusem). Na tych samych stronach Biblii można ją znaleźć towarzyszącego piekielnego ognia i awarii.
Uważa się, że domniemany zapach piekła ma związek z erupcjami wulkanów. Jego pierwszy odkrywca z pewnością musiał wpaść na kopalnie tego elementu, gdy kurz ląduje lub żółte kryształy w pobliżu wulkanu.
Antyk
Ta żółtowlą substancja stała wkrótce wykazała znaczące efekty gojenia. Na przykład Egipcjanie używali siarki do leczenia stanów zapalnych powiek. Zwolnił także świeciny i trądzik, aplikację, którą dziś można zobaczyć w mydłach siarkowych i innych przedmiotach dermatologicznych.
Rzymianie używali tego elementu w swoich rytuałach, takich jak Fumigante i Bleaching. Kiedy Librara SOS2, Gaz, który zalał pomieszczenia mieszające się z wilgocią i zapewniającym medium przeciwbakteryjne i zdolne do unicestania owadów.
Rzymianie, podobnie jak Grecy, odkryli wysoką palność siarki, więc stał się synonimem ognia. Kolor jego niebieskawych płomieni musiał oświetlić rzymskie cyrki. Uważa się, że Tymczasem Grecy używali tego elementu do tworzenia broni zapalającej.
Chińczycy po swojej stronie dowiedzieli się, że mieszanie siarki z Salepeter (Kno3) i węgiel stworzył czarny proch, który wypłacił historyczny obrót, i który wzbudził w narodach ówczesnych wielkich wymagań i zainteresowania tym minerałem.
Może ci służyć: okrągNowoczesne czasy
Jakby prochowi nie było wystarczającym powodem do pożądania siarki, kwasu siarkowego i przemysłowego wkrótce pojawiły się. A w przypadku różdżki kwasu siarkowego zmierzono ilość bogactwa lub dobrobytu kraju w odniesieniu do jego poziomu konsumpcji tego związku.
Dopiero 1789. Następnie w 1823 r. Niemiecki chemik Eilhard Mitscherlich odkrył, że siarka może głównie krystalizować na dwa sposoby: Rhomboédrica i monokliniczny.
Historia siarki była zgodna z tym samym kanałem jej związków i zastosowań. Z ogromnym przemysłowym znaczeniem kwasu siarkowego towarzyszył wulkanizacji gumów, syntezę penicylin, wydobywania, rafinację surowców olejowych siarkowych, odżywianie gleby itp.
Nieruchomości
Wygląd fizyczny
Bryza stała w kurzu lub kryształach. Jego kolor to nieprzezroczyste cytrynowe żółte, jest bez smaku i nie ma zapachu.
Płynny wygląd
Ciekła siarka jest pojedyncza, ponieważ jej początkowy żółty kolor staje się czerwonawy, nasila się i przyciemnia, jeśli ulega wysokie temperatury. Kiedy płonie, powiedz niebieskie i jasne płomienie.
Masa cząsteczkowa
32 g/mol.
Temperatura topnienia
115.21ºC.
Punkt wrzenia
445ºC.
punkt zapłonu
160ºC.
Temperatura samowystarczalności
232ºC.
Gęstość
2,1 g/ml. Jednak inne alotropy mogą być mniej gęste.
Molowa pojemność cieplna
22,75 J/mol · k
Radio Kowalencyjne
105 ± 15 pm.
Elektronialiczność
2.58 na skali Pauling.
Biegunowość
Łącza S-S są apolarne, ponieważ oba atomy siarki mają taką samą elektroonegatywność. To sprawia, że wszystkie jego alotropy, cykliczne lub w postaci łańcuchów, są apoliste; I dlatego jego interakcje z wodą są nieefektywne i nie można ich w nim rozpuszczyć.
Jednak siarka można rozpuścić w rozpuszczalnikach apolarnych, takich jak disiarczde węglowe, CS2, i aromatyczny (benzen, toluen, ksylen itp.).
Jony
Siarka może tworzyć kilka jonów, ogólnie aniony. Najbardziej znanym ze wszystkich jest siarczek, s2-. S2- Charakteryzuje się byciem nieporęcznym i miękką podstawą Lewisa.
Ponieważ jest miękką zasadą, teoria określa, że będzie ona tworzyć związki o miękkich kwasach; Jak przejściowe kationów metalowych, w tym wiara2+, Pb2+ i Cu2+.
Struktura elektroniczna i konfiguracja
Korona siarki
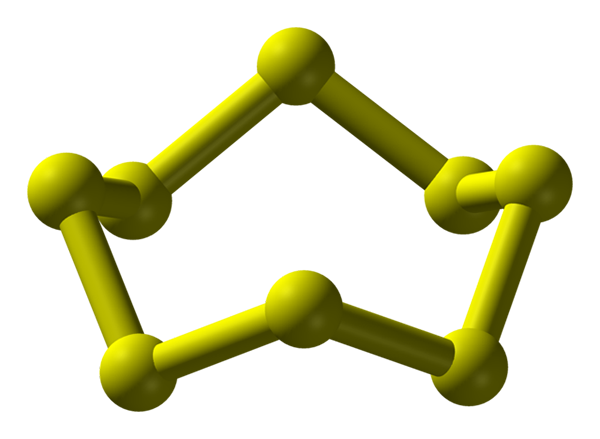 Cząsteczka S8, najbardziej stabilna i obfita alotropowa siarka. Źródło: Benjah-BMM27.
Cząsteczka S8, najbardziej stabilna i obfita alotropowa siarka. Źródło: Benjah-BMM27. Siarka może wystąpić w szerokiej gamie wolności; I z kolei mają krystaliczne struktury, które są modyfikowane pod różnymi ciśnieniami i/lub temperaturami. Dlatego siarka jest bogatym pierwiastkiem w wolności i polimorfach, a badanie jej stałych struktur stanowi niekończące się źródło prac teoretycznych-eksperymentalnych.
Dlaczego taka złożoność strukturalna? Na początek wiązania kowalencyjne w siarce (S-S) są bardzo silne, przezwyciężane tylko przez węgiel, C-C i wodór, H-H.
Siarka, w przeciwieństwie do węgla, nie ma tendencji do tworzenia czworościaków, ale bumerangów; że z ich kątami składają i dzwonią, aby ustabilizować łańcuchy siarki. Najbardziej znanym pierścieniem ze wszystkich, reprezentujący również najbardziej stabilny wolny siarkę, jest S8, „Korona siarki” (wyższy obraz).
Zauważ, że wszystkie linki S-S8 Wydają się indywidualne bumerangi, co skutkuje pierścieniem z fałdami i płaskimi. Te korony8 Wchodzą w interakcje przez siły londyńskie, zorientowane w taki sposób, że udało im się stworzyć wzorce strukturalne, które określają kryształ ortorombowy; zwane s8 α (S-α lub po prostu siarka ortorombowa).
Może ci służyć: elastyczne materiałyPolimorfy
Korona siarki jest jednym z wielu szczelnych dla tego elementu. S8 α jest polimorfem tej korony. Istnieją dwa inne (wśród najważniejszych) zwanych s8 β i s8 γ (odpowiednio S-β i S-γ). Oba polimorfy krystalizują w strukturach monoklinicznych, będąc S8 γ jest gęstsze (gamma siarki).
Trzy są żółtymi ciałami stałymi. Ale w jaki sposób każdy polimorf otrzymuje się osobno?
S8 β przygotowuje S8 α w 93 ° C, a następnie umożliwienie mu powolnego chłodzenia spowolnieniem powrotu do fazy ortorombowej (α). I s8 Z drugiej strony γ jest uzyskiwane, gdy jest oparty8 α w 150 ° C, pozwalając ponownie ostygnąć powoli; Jest to najsilniejszy z polimorfów korony siarki.
Inne cykliczne alotropy
Korona s8 To nie jest jedyny cykliczny alotrope. Są inne, takie jak s4, S5 (Analog do cyklopentano), s6 (reprezentowane przez sześciokąta, a także cykl), s7, S9, i s10-20; Ten ostatni oznacza, że mogą znajdować się pierścienie lub cykle zawierające od dziesięciu do dwudziestu atomów siarki.
Każdy z nich reprezentuje różne cykliczne alotrochy siarki; A z kolei, aby to podkreślić, mają odmiany polimorfów lub struktur polimorficznych, które zależą od ciśnienia i temperatury.
Na przykład S7 Ma do czterech znanych polimorfów: α, β, γ i δ. Członkowie lub korony o wyższych masach cząsteczkowych są produktami syntezy organicznej i nie dominują w naturze.
Łańcuchy siarki
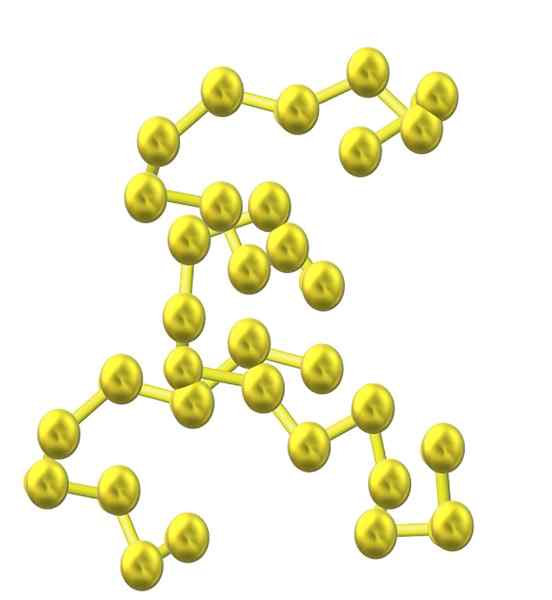 Łańcuch siarki. Źródło: Opentax [CC przez 4.0 (https: // creativeCommons.Org/licencje/według/4.0)]
Łańcuch siarki. Źródło: Opentax [CC przez 4.0 (https: // creativeCommons.Org/licencje/według/4.0)] Gdy więcej atomów siarki jest włączanych do struktury, ich tendencja do pierścienia zmniejsza się, a łańcuchy siarki pozostają otwarte i przyjmują spiralne konformacje (jakby były spiralem lub śrubami).
I zatem pojawia się kolejna obszerna rodzina alotropów siarki, która nie składa się z pierścieni lub cykli, ale z łańcuchów (takich jak obraz górny).
Kiedy te łańcuchy S-S wyrównują się równolegle do szkła, łapią zanieczyszczenia i ostatecznie definiują włóknistą substancję stałą zwaną włóknistą siarką lub S -rost. Jeśli wśród tych równoległych łańcuchów istnieją kowalencyjne wiązania, które je łączą (jak w przypadku wulkanizacji gumy), mamy siarkę laminarną.
Kiedy siarka s8 Rozpuszcza żółtawą fazę ciekłą, która może stać się ciemna, jeśli temperatura zostanie zwiększona. Wynika to z faktu, że łącza S-S są zepsute, a zatem występuje proces depolimeryzacji termicznej.
Ten ciecz, gdy chłodzi, wykazuje cechy plastikowe, a następnie szklistą; Oznacza to, że uzyskuje się szklistą siarkę i amorficzne (s-wre). Jego skład składa się zarówno z pierścieni, jak i łańcuchów siarki.
A gdy mieszaninę włóknistej i laminarnej jest uzyskiwana z amorficznej siarki, produkt komercyjny stosowany do wulkanizacji gumy.
Małe alotropy
Chociaż pozostają ostatnie, nie są mniej ważne (lub interesujące) niż alotropos największych mas cząsteczkowych. S2 i s3 są siarkowymi wersjami O2 I3. W pierwszych dwóch atomach siarki łączą się z podwójnym wiązaniem, s = s, aw drugim istnieją trzy atomy ze strukturami rezonansowymi, s = s-s.
Oba s2 jak s3 Są gazowe. S3 Manifest A Cherry Red Coloration. Obaj mają wystarczającą ilość materiałów bibliograficznych, aby każdy z nich obejmuje indywidualny artykuł.
Elektroniczna Konfiguracja
Konfiguracja elektroniczna atomu siarki wynosi:
[Ne] 3s2 3p4
Możesz zarobić dwa elektrony, aby ukończyć okteto w Walencji, a tym samym mieć stan utleniania -2. Podobnie możesz stracić elektrony, zaczynając od dwóch w orbitalach 3P, będąc jego stanem utleniania +2; Jeśli stracisz jeszcze dwa elektrony, z pustymi orbitalami 3P, twój stan utleniania wyniesie +4; A jeśli stracisz wszystkie elektrony, będzie to +6.
Może ci służyć: metaloidyUzyskanie tego, gdzie jest siarka?
Mineralogiczne
Siarka jest częścią wielu minerałów. Wśród nich są piryt (fes2), La Galena (PBS), Covellita (CUS) i inne minerały siarczanu i siarczków. Przetwarzając je, nie tylko metale można wyodrębnić, ale także siarkę po serii reakcji redukcyjnych.
Można go również uzyskać wyłącznie w otworach wulkanicznych, gdzie gdy temperatura jest podniesiona i rozlewa się w dół; A jeśli się podpalił, będzie wyglądał jak niebieskawa lawa. Poprzez żmudną pracę i uciążliwe prace fizyczne, siarkę można zbierać, ponieważ wykonywano ją dość często na Sycylii.
Siarka można również znaleźć w podziemnych kopalniach, które są wytwarzane w celu pompowania wody do stopienia i przeniesienia na powierzchnię. Ten proces uzyskiwania jest znany jako proces brasch, obecnie niewiele używany.
Ropa naftowa
Obecnie większość siarki pochodzi z przemysłu naftowego, ponieważ jej związki organiczne są częścią składu ropy naftowej i rafinowanych pochodnych.
Jeśli wyrafinowana ropa lub produkt jest bogaty w siarkę i ulegnie hydrodosulfuryzacji, uwolni duże ilości h2S (śmierdzący gaz, który pachnie jak zgniłe jajka):
R-S-R + 2 H2 → 2 RH + H2S
Potem h2S Jest chemicznie w procesie Claussa, podsumowanym następującymi równaniami chemicznymi:
3 o2 + 2 godz2S → 2 SO2 + 2 godz2ALBO
południowy zachód2 + 2 godz2S → 3 S + 2 H2ALBO
Aplikacje
Niektóre zastosowania siarki są wymienione poniżej i ogólnie:
- Jest to niezbędny element zarówno dla roślin, jak i zwierząt. Jest nawet obecny w dwóch aminokwasach: cysteina i metodę.
- Jest to surowiec do kwasu siarkowego, złożony w przygotowaniu niezliczonych produktów komercyjnych.
- W branży farmaceutycznej jest przeznaczony do syntezy pochodnych siarki, a penicylina jest najbardziej znaną z przykładów.
- Umożliwia wulkanizację gumów poprzez połączenie łańcuchów polimerowych z łączami S-S.
- Jego żółty kolor i mieszanki z innymi metali sprawiają, że jest pożądany w przemyśle pigmentowym.
- Zmieszane z matrycą nieorganiczną, taką jak piasek i skały, beton i asfalt siarki jest przygotowywany do wymiany bitumu.
Ryzyko i środki ostrożności
Siarka sama jest niezadowoloną, nietoksyczną substancją i reprezentuje również potencjalne ryzyko, chyba że reaguje na inne związki. Jego sole siarczanowe nie są niebezpieczne i można je manipulować bez głównych środków ostrożności. Nie dzieje się tak jednak z jego gazowymi pochodnymi: więc2 i H2S, oba wyjątkowo toksyczne.
Jeśli jest w fazie ciekłej, może to powodować poważne oparzenia. Jeśli pochłania w dużych ilościach, H może wywołać2S w jelicie. Dla reszty nie stanowi to żadnego ryzyka dla tych, którzy żuli.
Ogólnie rzecz biorąc, siarka jest pewnym elementem, który nie wymaga zbyt wielu środków ostrożności, z wyjątkiem trzymania go z dala od ognia i silnych środków utleniających.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Laura Crapanzano. (2006). Polimorfizm siarki: aspekty strukturalne i dynamiczne. Fizyka [fizyka].University Joseph -fourier - Grenoble I. język angielski. FFTEL-00204149F
- Wikipedia. (2019). Alotropy siarki. Źródło: w:.Wikipedia.org
- Meyer pokonał. (1976). Elementarna siarka. Recenzje chemiczne, vol. 76, nie. 3.
- Dr. Doug Stewart. (2019). Fakty elementów siarki. Chemicool. Odzyskane z: Chemicool.com
- Donald w. Davis i Randall A. Detro. (2015). Historia siarki. Georgia Gulf Sulfur Corporation. Odzyskane z: Georgiagulfsulfur.com
- Helmestine, Anne Marie, pH.D. (11 stycznia 2019). 10 interesujących faktów siarki. Odzyskane z: Thoughtco.com
- Boone, c.; Bond, c.; Hallman, a.; Jenkins, J. (2017). Ogólny arkusz informacyjny siarki; National Pesticide Information Center, Oregon State University Extension Services. Npi.Orst.Edu
- « Niezależność od Meksyku, rozwój, konsekwencje, postacie
- Flora i fauna gatunków reprezentatywnych Jalisco »

