Amphoters, typy i przykłady
- 2165
- 135
- Maksymilian Kępa
Amfosttery Są to związki lub jony, które mają osobliwość zachowania się jako kwas lub jako podstawa, zgodnie z teorią Bronsteda i Lowry'ego. Jego imię pochodzi od greckiego słowa Amphoteroi, co oznacza „oba”.
Wiele metali tworzy tlenki lub wodorotlenki amphoteros, w tym miedź, cynk, cyna, ołów, aluminium i beryl. Charakterystyka amfotera tych tlenków zależy od stanów utleniania danego tlenku. Pod koniec artykułu są uwzględnione przykłady tych substancji.

Tlenki metali, które mogą reagować z kwasami i zasadami w celu wytwarzania soli i wody, są znane jako tlenki amphoteros. Tlenki ołowiu i cynku są bardzo dobrymi przykładami, wśród innych związków.
[TOC]
Co to jest amphoter?
Zgodnie z teorią kwasową Bronsteda i Lowry, kwasy to substancje, które przekazują protony, podczas gdy zasady to te, które akceptują lub biorą protony.
Cząsteczka zwana amfotanem będzie miała reakcje, w których nabywa protony, ponieważ będzie miała również możliwość ich przekazania (chociaż nie zawsze tak, jak będzie widać w następnej sekcji).
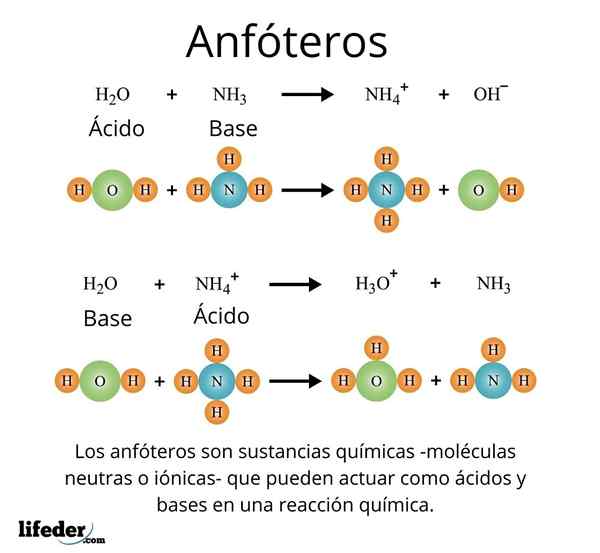
Ważnym i dobrze rozpoznawanym przypadkiem jest uniwersalny rozpuszczalnik, woda (H₂O). Ta substancja łatwo reaguje na kwasy, na przykład w reakcji z kwasem solnym:
H2O + HCl → H3ALBO+ + Cl-
Ale z kolei nie ma również problemów reagowania z bazą, jak w przypadku amoniaku:
H2O + nh3 → NH4 + Oh-
Z tymi przykładami można zaobserwować, że woda działa w pełni jako substancja amfotate.
Rodzaje amfoterów
Mimo że substancje amfotencjalne mogą być cząsteczkami lub jonami, istnieją cząsteczki, które najlepiej pokazują charakterystykę amfotencjalną i pomagają lepiej badać to zachowanie: substancje amfrofrotowe. Są to cząsteczki, które mogą konkretnie przekazać lub zaakceptować proton, aby działać jako kwas lub zasada.
Może ci służyć: Rodio: Historia, właściwości, struktura, zastosowania, ryzykoNależy wyjaśnić, że wszystkie substancje amfotyczne są amfotyczne, ale nie wszystkie amfotery są amfiprtyczne; Są amphotoros, którzy nie mają protonów, ale mogą zachowywać się jak kwasy lub podstawy na inne sposoby (takie jak teoria Lewisa).
Wśród substancji amfiprtycznych są woda, aminokwasy i jony wodorowęglanowe i siarczanowe. Z kolei substancje amfrofotyczne są również podklasyfikowane zgodnie z ich zdolnością do przekazywania protonów lub wytwarzania protonów:
Substancje protogenne lub kwasu amfiprytynowego
Są tymi, które mają większą tendencję do dawania protonu niż zaakceptowania jednego. Wśród nich są kwas siarkowy (h2południowy zachód4) i kwas octowy (cho3Cooh), między innymi.
Podstawowe substancje protofilowe lub amfotyczne
Są tymi, dla których akceptacja protonu jest bardziej powszechna niż jego ustalenie. Wśród tych substancji można znaleźć amoniak (NH3) i etyllendiamid [c2H4(NH2)2].
Substancje neutralne
Mają taką samą łatwość lub zdolność do zaakceptowania protonu, aby go zrezygnować. Wśród nich jest woda (h2O) i mniejsze alkohole (-roh), głównie.
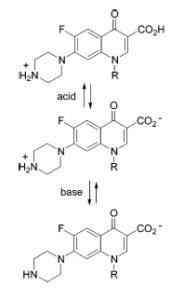 AMPOTERO Charakter quinolonów
AMPOTERO Charakter quinolonów Przykłady substancji amfotencjalnych
 Napięcie Amphotero
Napięcie Amphotero Teraz opisałeś już substancje amfotencjalne, konieczne jest oznaczenie przykładów reakcji, w których te cechy są prezentowane.
Jon kwasu węglowego przedstawia podstawowy przypadek substancji amfiprtycznej; Następnie ich reakcje są reprezentowane, gdy działa jak kwas:
HCO3- + Oh- → CO32- + H2ALBO
Następna reakcja występuje, gdy działa jako podstawa:
HCO3- + H3ALBO+ → H2WSPÓŁ3
Istnieje również wiele innych substancji. Z nich są następujące przykłady:
Tlenki Amphoteros
Tlenek cynku, jak już wspomniano, jest amphotero, ale nie substancją amfiprtyczną. Następnie pokazano, dlaczego.
Może ci służyć: Justus von LiebigZachowując się jak kwas:
ZnO + H2południowy zachód4 → Znso4 + H2ALBO
Zachowanie się jako baza:
ZnO + 2NAOH + H2O → na2[Zn (OH)4]
Tlenek ołowiu (PBO), aluminium (AL2ALBO3) i Tin (SNO) mają również swoje własne cechy amfotencjalne:
Zachowując się jak kwasy:
PBO + 2HCl → PBCL2 + H2ALBO
Do2ALBO3 + 6HCl → 2Alcl3 + 3H2ALBO
Sno + HCl ↔ Sncl + H2ALBO
I jako podstawy:
PBO + 2NAOH + H2O → na2[PB (OH)4]
Do2ALBO3 + 2NAOH + 3H2O → 2na [al (OH)4]
Sno + 4naOH + H2Lub ↔ na4[SN (OH)6]
Istnieją również tlenki Amphoteros z Galii, Indii, Scandio, Titanium, okrąg i telurio.
Hydroksydki Anfoter
Hydroksydki mogą również stanowić charakterystykę amfotencjalną, na przykład w przypadkach wodorotlenku aluminium i berylu. Oba przykłady są obserwowane poniżej:
Wodorotlenek glinu jako kwas:
AL (OH)3 + 3HCl → ALCL3 + 3H2ALBO
Wodorotlenek aluminiowy jako podstawa:
AL (OH)3 + Naoh → na [al (OH)4]
Wodorotlenek berylu jako kwas:
Być (oh)2 + 2HCl → Becl2 + H2ALBO
Wodorotlenek berylu jako baza:
Być (oh)2 + 2NAOH → NA2[BE (OH)4]
Różnice między amphoteros, amphiprtic, amfolity i apatyki
Należy wiedzieć, jak różnicować pojęcie każdego terminu, ponieważ jego podobieństwo może stać się mylące.
Wiadomo, że amphotoros są substancjami, które zachowują się jak kwasy lub zasady w reakcji, która wytwarza sól i wodę. Mogą to zrobić w celu darowizny lub schwytania protonu lub po prostu akceptując elektroniczny moment obrotowy (lub dając mu) zgodnie z teorią Lewisa.
Z drugiej strony substancje amfotyczne to te amphoters, które działają jak kwasy lub podstawy z darowizną lub pobieraniem protonu, zgodnie z prawem Bronsteda-Lowry'ego. Wszystkie substancje amfotyczne są amfotyczne.
Może ci służyć: benzoina: struktura, właściwości, zastosowania i ryzykoZwiązki ampolityczne są cząsteczkami amfotencjalnymi, które istnieją jako ztolity i mają jony dipolowe w niektórych przypadkach pH. Są one używane jako środki tłumienia w roztworach buforowych.
Wreszcie, rozpuszczalniki ściskające to ci, którzy nie mają protonów do poddania się i nie mogą ich zaakceptować.
Bibliografia
- Amfoteryczny. (2008). Wikipedia. Uzyskane z in.Wikipedia.org
- Anne Marie Helmestine, str. (2017). Co oznacza amfoteryczne w chemii?. Uzyskane z Thoughco.com
- Bicpuc. (2016). Związki amfoteryczne. Uzyskane z Medum.com
- Chemicool. (S.F.). Definicja amfoterycznego. Uzyskane z Chemicool.com.

