Ogólne aspekty, funkcje i przykłady

- 2834
- 863
- Eugenia Czapla
On Alosterizm Regulacja o alostric jest definiowana jako proces hamowania lub aktywacji enzymu za pośrednictwem cząsteczki regulacyjnej innej od jej substratu i działa w określonym miejscu jego struktury, inaczej niż w miejscu aktywnym tego samego tego samego.
Termin „aloster” lub „alosterizm” pochodzi z greckich korzeni ”Allos ", co oznacza „inny” i „Stereós”, co oznacza „formularz” lub „miejsce”; Tak dosłownie tłumaczy się jako „inna przestrzeń”, „inne miejsce” lub „inna struktura”.
 Schemat graficzny regulacji teosterycznej. (A) Aktywna strona. (B) Witryna alosteryczna. (C) substrat. (D) inhibitor. (E) enzym. (Źródło: Isaac Webb [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Schemat graficzny regulacji teosterycznej. (A) Aktywna strona. (B) Witryna alosteryczna. (C) substrat. (D) inhibitor. (E) enzym. (Źródło: Isaac Webb [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) Niektórzy autorzy opisują alosterizm jako proces, w którym odległe miejsca w układzie (na przykład struktura enzymu) są energetycznie sprzężone, aby uzyskać odpowiedź funkcjonalną, dlatego można założyć, że zmiana w regionie może wpływać na dowolną inną inną w tym samym.
Ten rodzaj regulacji jest typowy dla enzymów, które uczestniczą w wielu znanych procesach biologicznych, takich jak transdukcja sygnału, metabolizm (anabolizm i katabolizm), regulacja ekspresji genetycznej, między innymi, między innymi.
Pierwsze pomysły na temat alosterizmu i ich udział w kontroli metabolizmu komórkowego zostały postulowane w latach 60. XX wieku. Monod, f. Jacob i J. Zmiana, podczas badania tras biosyntetycznych różnych aminokwasów, które były hamowane po nagromadzeniu produktów końcowych.
Chociaż pierwsza publikacja w tym względzie dotyczyła regulacji genetycznej, w krótkim czasie później Monod, Wyman i Changeux rozszerzyły koncepcję alosterizmu na białka z aktywnością enzymatyczną i zaproponowała model oparty na białkach multimerycznych, głównie poparty interakcjami między podjednostkami, gdy dowolne z nich dołączyło do efektora.
Może ci służyć: Guanina: Charakterystyka, struktura, szkolenie i funkcjeWiele kolejnych pojęć miało swoje podstawy w teorii „indukowanej korekty”, która została wprowadzona przez Koshland kilka lat wcześniej.
[TOC]
Główne cechy
Zasadniczo wszystkie enzymy mają dwa różne miejsca dla Unii ligandu: jedno jest znane jako miejsce aktywne, które łączy cząsteczki, które działają jako substrat (odpowiedzialny za aktywność biologiczną enzymu), a drugie to drugie znane jako teosteryczne Witryna, która jest specyficzna dla innych metabolitów.
Te „inne metabolity” są nazywane efektorami Alestherami i mogą mieć pozytywny lub negatywny wpływ na szybkość reakcji katalizowanych przez enzymy lub w powinowactwie, z którymi łączą się podłoża w miejscu aktywnym.
Zwykle związek efektora na AL, miejsce enzymu powoduje wpływ na inne miejsce struktury, modyfikując jej aktywność lub wydajność funkcjonalną.
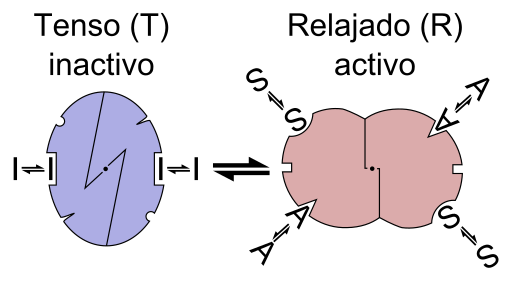 Schemat graficzny reakcji enzymu alosterica (źródło: plik: enzym allostery to.PNG: Plik: enzym allostery.PNG: Allostery.PNG: Nicolas Le Novere (Talk).Lenov w In.Praca Wikipediderivative: Timvickers (dyskusja) Praca pochodna: Retama (Talk) Praca pochodna: KES47 [CC BY-SA (https: // CreativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons)
Schemat graficzny reakcji enzymu alosterica (źródło: plik: enzym allostery to.PNG: Plik: enzym allostery.PNG: Allostery.PNG: Nicolas Le Novere (Talk).Lenov w In.Praca Wikipediderivative: Timvickers (dyskusja) Praca pochodna: Retama (Talk) Praca pochodna: KES47 [CC BY-SA (https: // CreativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons) Innymi słowy, połączenie efektora Alestro w jego specyficzne miejsce w strukturze enzymu powoduje zmianę geometrii molekularnej enzymu, znanego jako przejście do teosterki, to znaczy jest zdarzenie, które jest przekazywane W całej makrocząsteczce modyfikując jego zachowanie.
Alosterizm może być homotropowy lub heterotropowy. Homotropowy proces regulacji Alostroic jest definiowany jako ten, w którym ten sam substrat enzymu działa jako jego regulator Alestryczny, to znaczy, że efektor alosterowy jest tym samym substratem; Jest również znany jako rodzaj spółdzielni.
Z drugiej strony heterotropowy proces regulacji odnosi się do regulacji aktywności enzymu za pośrednictwem cząsteczki lub efektora teosterycznego, który różni się od jej substratu i może również mieć pozytywny lub negatywny wpływ na aktywność enzymu enzymu.
Może ci służyć: Aptenia cordifolia: Charakterystyka, siedlisko, właściwości, uprawaFunkcje
Alosterizm, wraz z regulacją ekspresji genetycznej, translacji i degradacji białka, jest jednym z podstawowych mechanizmów regulacji dużej liczby procesów organicznych, co jest niezbędne do utrzymania homeostazy i przeżycia wszystkich żywych, jednokomórkowych lub wielokomórkowych istoty.
Regulacja toostalna lub alosterizm daje żywych organizmach zdolność do reagowania z dużą wrażliwością na zmiany w stężeniu ligandów regulacyjnych, a także powstanie zjawisk rytmicznych na poziomie komórkowym na poziomie komórkowym.
Ponieważ energia i substraty metaboliczne są skończone w komórce, alosterizm pozwala w polu metabolicznym, umiarkowane wykorzystanie zasobów, unikając zarówno bezużytecznych cykli, jak i marnotrawstwa energii do nadmiernego przetwarzania substratów w warunkach obfitości lub niedoboru.
Podobnie ten mechanizm regulacji ma ogromne znaczenie dla procesów sygnalizacji komórkowej, w których zaangażowanych jest wiele zmian konformacyjnych, które są wywoływane przez połączenie różnych ligandów w określonych miejscach danych receptorów.
Przykłady alosterizmu
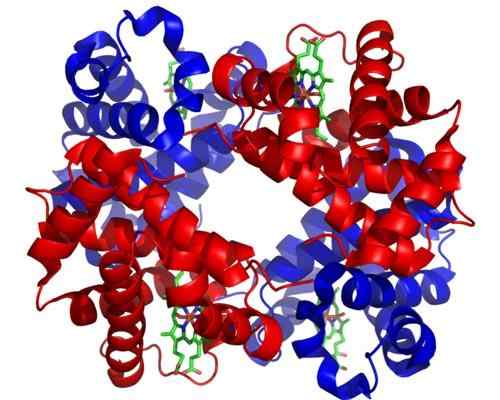 Hemoglobina. Zrobione i zredagowane z: Zephyris w języku angielskim Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]].
Hemoglobina. Zrobione i zredagowane z: Zephyris w języku angielskim Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Chociaż istnieją tysiące przykładów tosterizmu lub regulacji w naturze, niektóre były bardziej widoczne niż inne. Tak jest w przypadku hemoglobiny, która była jednym z pierwszych białek opisanych dogłębnie w aspekcie strukturalnym.
Hemoglobina jest bardzo ważnym białkiem dla wielu zwierząt, ponieważ jest odpowiedzialna za transport tlenu przez krew z płuc do tkanek. To białko przedstawia jednocześnie homotropową i heterotropową regulację teosterską.
Może ci służyć: stacyonizm: cechy, dowody i przykładyHomotropowy alosterizm hemoglobiny ma związek z połączeniem cząsteczki tlenu do jednej z podjednostek, które tworzą ją bezpośrednio wpływa na powinowactwo, z jaką podjednostka sąsiadująca z inną cząsteczką tlenu, zwiększając ją (regulacja dodatnia lub kooperatymizmu).
Heterotropowy do heterotropowego
Z drugiej strony heterotropowy alosterizm jest związany z skutkami zarówno pH, jak i obecności 2,3-dyfoglikatu na połączenie tlenu na podjednostki tego enzymu, hamując go.
Tranbamilaza lub asparaginian ATCASA, który uczestniczy w drogi syntezy pirymidyny, jest również jednym z „klasycznych” przykładów regulacji alosterowej. Ten enzym, który ma 12 podjednostek, z czego 6 jest katalitycznie aktywnych, a 6 jest regulatorami, jest heterotropowo hamowany przez końcowy produkt trasy, którą kieruje, cytydynoinatrifosforan (CTP).
Operon laktozy I. coli
Owoc pierwszych pomysłów Monoda, Jacob i Changeaux był artykułem opublikowanym przez Jacoba i Monoda związanego z laktozą laktozy laktozy Escherichia coliSiema, który jest jednym z typowych przykładów regulacji poziomu heterotropowego do poziomu genetycznego.
Regulacja tego systemu nie jest związana z zdolnością do przekształcania podłoża w produkt, ale z powinowactwem połączenia białka do działającego regionu DNA.
Bibliografia
- Changeux, J. P., & Edelstein, s. J. (2005). Allosteryczne mechanizmy transdukcji sygnału. Science, 308 (5727), 1424-1428.
- Goldbeter, a., I Dupont, G. (1990). Regulacja allosteryczna, spółdzielnia i oscylacje biochemiczne. Chemia biofizyczna, 37 (1-3), 341-353.
- Jiao, w., I Parker i. J. (2012). Wykorzystanie komponowania technik obliczeniowych i eksperymentalnych w celu zrozumienia molekularnej podstawy dla allostery białkowej. W postępach w chemii białek i biologii strukturalnej (vol. 87, pp. 391-413). Academic Press.
- Kern, d., I Zuiderweg i. R. (2003). Rola dynamiki w regulacji allosterycznej. Obecna opinia w biologii strukturalnej, 13 (6), 748-757.
- Laskowski, r. DO., Gerick, f., & Thornton, J. M. (2009). Strukturalne podstawy regulacji allosterycznej w białkach. Listy FEBS, 583 (11), 1692-1698.
- Mathews, c. K., Van Holde, K. I., & Ahern, K. G. (2000). Biochemistry, wyd. San Francisco, Kalifornia.
- « Struktura nanorurek węglowych, właściwości, zastosowania, toksyczność
- Adaptacyjny proces promieniowania, typy i przykłady »

