Trzeciorzędowa struktura alkoholu, właściwości, przykłady
- 2398
- 684
- Eugenia Czapla
A Alkohol trzeciorzędowy Jest to taki, w którym grupa hydroksylowa, OH, jest powiązana z trzeciorzędowym węglem. Jego formuła nadal jest ROH, podobnie jak inne alkohole; Ale można go łatwo rozpoznać, ponieważ OH jest blisko X w strukturze molekularnej. Ponadto jego węglany łańcuch jest zwykle krótszy, a jego główna masa cząsteczkowa.
Następnie alkohol trzeciorzędowy jest zwykle cięższy, jest bardziej rozgałęziony, a także jest najmniej reaktywny w odniesieniu do utleniania; Oznacza to, że nie można go przekształcić w cetone lub kwas karboksylowy, jak występuje odpowiednio w przypadku alkoholi wtórnych i pierwotnych.
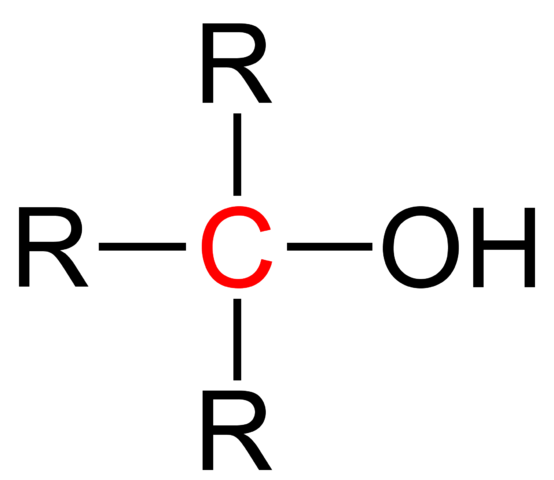
 Strukturalna formuła trzeciorzędowego alkoholu. Źródło: Jü [domena publiczna].
Strukturalna formuła trzeciorzędowego alkoholu. Źródło: Jü [domena publiczna]. Ogólna formuła strukturalna dla trzeciorzędowego alkoholu jest pokazana na górnym obrazie. Według niej można napisać nową formułę typu R3COH, gdzie R może być grupą alkilową lub arylową; Grupa metilo, ch3, lub krótki lub długi węglany łańcuch.
Jeśli trzy grupy R są różne, centralny węgiel trzeciorzędowy alkohol będzie chiralny; to znaczy alkohol przedstawiał aktywność optyczną. W tym fakcie, trzeciorzędowe quiralne alkohole pobierają zainteresowanie w branży farmaceutycznej, ponieważ od ketonów z aktywnością biologiczną alkohole są syntetyzowane za pomocą bardziej złożonych struktur.
[TOC]
Struktura trzeciorzędowego alkoholu
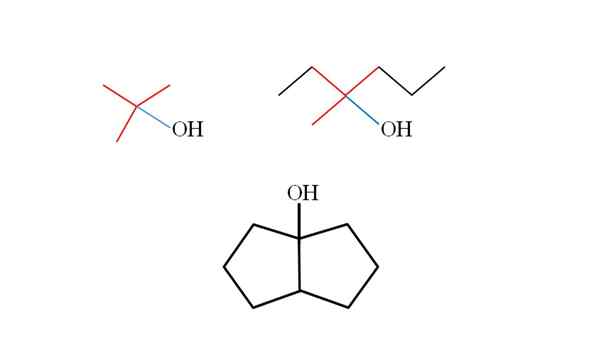 Trzy trzeciorzędowe alkohole i ich struktury. Źródło: Gabriel Bolívar.
Trzy trzeciorzędowe alkohole i ich struktury. Źródło: Gabriel Bolívar. Rozważ struktury górnych trzeciorzędowych alkoholi, aby nauczyć się je rozpoznawać, niezależnie od związku. Węgiel powiązany z OH musi być również powiązany z trzema innymi węglemi. Jeśli jest to szczegółowo obserwowane, trzy alkohole są zgodne z tym.
Pierwszy alkohol (po lewej), składa się z trzech grup Ch3 Central Carbon połączony, którego formuła byłaby (Cho3)3Coh. Grupa wynajmu (wybierz3)3C- jest znany jako tertbutil.
Może ci służyć: potencjometr (fametr)Drugi alkohol (po prawej), ma centralną linę węglową3, Ch3Ch2 i rozdz2Ch2Ch3. Ponieważ trzy grupy są różne, alkohol jest chiralny, a zatem wykazuje aktywność optyczną. T nie obserwuje się tutaj, ale X bliski OH (czerwony i niebieski).
A w trzecim alkoholu (poniżej i bez kolorów) OH jest powiązany z jednym z dwóch węgli, które dołączają do dwóch cyklopentano. Ten alkohol nie przedstawia aktywności optycznej, ponieważ dwie grupy centralne połączone z węglem są identyczne. Podobnie jak drugi alkohol, jeśli jest starannie obserwowany, zostanie również znaleziony X (raczej tetrahedron).
Przeszkoda steryczna
Trzy lepsze alkohole mają coś bardziej wspólnego niż X: Centralny węgiel sterycznie zapobiega; Oznacza to, że otaczają go wiele atomów w kosmosie. Bezpośrednim konsekwencją jest to, że nukleofily, chętne do pozytywnych ładunków, mają trudności z podejściem do tego węgla.
Z drugiej strony, mając trzy węgiel połączony z węglem centralnym, przekazują część gęstości elektronicznej, którą odejmuje atom elektroenegtacyjny tlenu, stabilizując go jeszcze bardziej przed tymi atakami nukleofilowymi. Jednak trzeciorzędowy alkohol może cierpieć podstawienie przez tworzenie karbokacji.
Nieruchomości
Fizyczny
Trzecie alkohole zazwyczaj przedstawiają wysoce rozgałęzione struktury. Pierwszą konsekwencją tego jest to, że grupa OH jest zapobiegana, a zatem jej moment dipolowy wywiera niewielki wpływ na sąsiednie cząsteczki.
Przekłada się to na słabsze interakcje molekularne w porównaniu z interakcjami pierwotnymi i wtórnymi.
Może ci służyć: zasada Le ChâtelierRozważmy na przykład izomery strukturalne butanolu:
Ch3Ch2Ch2Oh (N-Butanol, PEB = 117ºC)
(Ch3)2Ch2Och (alkohol izobuticzny, PEB = 107ºC)
Ch3Ch2CH (OH) CH3 (Alkohol secbutilic, PEB = 98ºC)
(Ch3)3COH (alkohol tertbutiliczny, PEB = 82ºC)
Zwróć uwagę na to, jak wrzące punkty schodzą, gdy izomer staje się bardziej rozgałęziony.
Początkowo wspomniano, że w strukturach alkoholi 3 i x x. Dlatego te alkohole mają zwykle niższe punkty topnienia i/lub wrzenia.
Nieco podobny jest przypadek mieszalności z wodą. Im bardziej zapobiegało mniej mieszkańcom OH, alkohol 3 z wodą. Jednak ta mieszalność zmniejsza dłuższy łańcuch węglowy; Zatem alkohol termiczny jest bardziej rozpuszczalny i mieszany z wodą niż N-Butanol.
Kwasowość
Alkohole trzeciorzędowe są zwykle najmniejszymi kwasami. Przyczyny są liczne i odnoszą się do siebie. Podsumowując, ujemne obciążenie jego pochodnego alcoxku, czerwony-, Poczujesz silną odpychanie dla trzech grup alkacznych związanych z centralnym węglem, osłabiając anion.
Im bardziej niestabilny anion, tym mniej będzie kwasowość alkoholu.
Reaktywność
Trzecie alkohole nie mogą ponieść utleniania ketonów (r2C = O) lub aldehydo (RCHO) lub kwasy karboksylowe (RCOOH). Z jednej strony musiałbym stracić jeden lub dwa węgle (w postaci CO2) do utleniania, co zmniejsza jego reaktywność przeciwko utlenianiu; A z drugiej strony nie ma wodoru, który może stracić, aby utworzyć kolejny związek z tlenem.
Może ci służyć: pirydyna: struktura, właściwości, zastosowania, toksyczność, syntezaMogą jednak cierpieć podstawienie i eliminację (tworzenie się podwójnego wiązania, alken lub olefin).
Nomenklatura
Nomenklatura tych alkoholi nie różni się od innych. Istnieją wspólne lub tradycyjne nazwy, a systematyczne nazwy rządzone przez IUPAC.
Jeśli główny łańcuch i jego konsekwencje składają się z uznanej grupy wynajmu, jest używany do tradycyjnej nazwy; Gdy nie jest to możliwe, używana jest nomenklatura IUPAC.
Rozważmy na przykład następujący alkohol trzeciorzędowy:
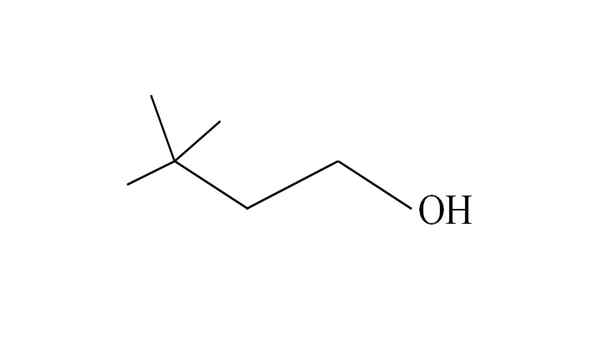 3.3-dimetylo-1-butanol. Źródło: Gabriel Bolívar.
3.3-dimetylo-1-butanol. Źródło: Gabriel Bolívar. Zaczyna wymieniać węgle od prawej do lewej. W C-3 istnieją dwie grupy CH3 podstawników, a zatem nazwa tego alkoholu wynosi 3,3-dimetylo-1-butanol (główny łańcuch ma cztery węgle).
Podobnie cały łańcuch i jego konsekwencje składają się z grupy Neohexilo; Dlatego jego tradycyjną nazwą może być alkohol neoheksylowy lub neoheksanol.
Przykłady
Wreszcie wspomniane są niektóre przykłady trzeciorzędowych alkoholi:
-2-metylo-2-propanol
-3-metylo-3-heksanol
-Biciclo [3,3,0] Octan-1-ol
-2-metylo-2-butanol: Ch3Ch2Coh (rozdz3)2
Formuły pierwszych trzech alkoholi są reprezentowane na pierwszym zdjęciu.
Bibliografia
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. (Edycja 5). Redakcja Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Gunawardena Gamini. (31 stycznia 2016 r.). Alkohol trzeciorzędowy. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Ashenhurst James. (16 czerwca 2010). Alkohole (1) - nomenklatura i nieruchomości. Odzyskane z: MastorganicChemistry.com
- Clark J. (2015). Wprowadzanie alkoholi. Odzyskane z: chemguide.współ.Wielka Brytania
- Chemia organiczna. (S.F.). Temat 3. Alkohole. [PDF]. Odzyskany z: sinorg.Uji.Jest
- Nilanjana Majumdar. (3 marca 2019 r.). Synteza chiralnego alkoholu trzeciorzędowego: znaczący rozwój. Odzyskane z: 2.Chemia.MSU.Edu
- « Okres kształtujący pochodzenie Ameryki, cechy, produkty
- Jak było społeczeństwo europejskie w pierwszej połowie XIX wieku »

