Alkohol wtórny, co jest, struktura, właściwości, używa
- 2206
- 185
- Pani Waleria Marek
Co to jest alkohol wtórny?
A alkohol wtórny Ma węgiel węglowy grupy hydroksylowej (OH), przymocowany do dwóch węgli. Tymczasem w alkoholu pierwotnym węgiel węglowy grupy hydroksylowej jest powiązany z atomem węgla, a w trzeciorzędowym alkoholu przyłączonym do trzech atomów węgla.
Alkohole są nieco słabszymi kwasami niż woda, z następującymi PKA: woda (15,7); Alkohole metylowe (15,2), etyl (16), izopropyl (alkohol wtórny, 17) i termiczny (18). Jak widać, alkohol izopropylowy jest mniej kwaśny niż alkohol metylu i etylu.
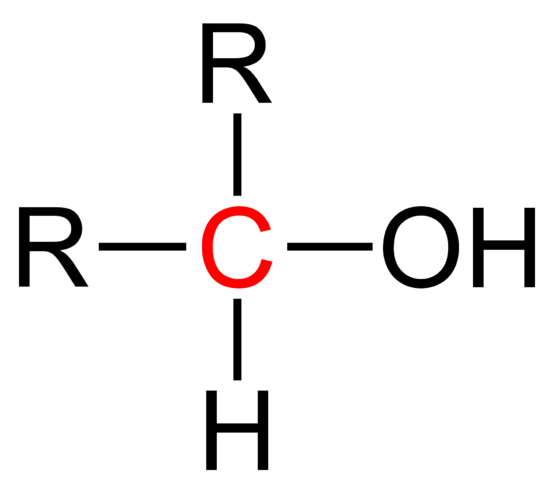
 Strukturalna formuła alkoholu wtórnego. Wikimedia Commons
Strukturalna formuła alkoholu wtórnego. Wikimedia Commons Na górnym obrazie pokazano formułę strukturalną dla alkoholu wtórnego. Czerwony węgiel jest nosicielem OH i jest powiązany z dwiema grupami alkilowymi (lub arylowymi) R i pojedynczym atomem wodoru.
Wszystkie alkohole mają ogólną formułę ROH; Ale jeśli nosiciel jest obserwowany szczegółowo, wówczas uzyskuje się pierwotne alkohole (RCH2Och), wtórny (r2Choh, wychowany tutaj) i trzeciorzęd3Coh). Fakt ten robi różnicę w jego właściwościach fizycznych i reaktywności.
Struktura alkoholu wtórnego
Struktury alkoholu zależą od charakteru grup R. Jednak w przypadku alkoholi wtórnych można wprowadzić pewne przykład, biorąc pod uwagę, że mogą istnieć tylko struktury liniowe z konsekwencjami lub bez nich lub struktury cykliczne. Na przykład masz następujący obraz:
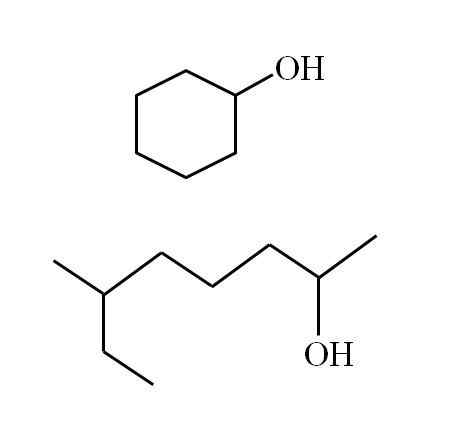 Cykliczny alkohol wtórny i inny rozgałęziony łańcuch. Źródło: Gabriel Bolívar
Cykliczny alkohol wtórny i inny rozgałęziony łańcuch. Źródło: Gabriel Bolívar Zauważ, że dla obu struktur jest coś wspólnego: OH jest powiązany z „V”. Każdy koniec V reprezentuje równą grupę (górna część obrazu, struktura cykliczna) lub inna (dolna część, łańcuch rozgałęziony).
W ten sposób każdy wtórny alkohol jest bardzo łatwo zidentyfikowany, nawet jeśli jego nomenklatura jest w ogóle nieznana.
Nieruchomości
Punkty wrzenia
Właściwości wtórnych alkoholi nie różnią się zbytnio od innych alkoholi. Zwykle są przezroczystymi cieczami i aby być stałym w temperaturze pokojowej, musi utworzyć kilka mostów wodoru i mieć wysoką masę cząsteczkową.
Może ci służyć: kwas okołokromowy (HBRO4): właściwości, ryzyko i zastosowaniaJednak ta sama formuła strukturalna r2Choh sugeruje ogólnie pewne unikalne właściwości dla tych alkoholi. Na przykład grupa OH jest mniej odsłonięta i dostępna dla interakcji mostów wodorowych, r2CH-OH-OHCHR2.
Wynika to z faktu, że grupy R, przylegające do węgla węgla samochodowego, można przynieść i utrudnia tworzenie mostów wodorowych. W rezultacie alkohole wtórne mają niższe temperatury wrzenia niż pierwotne (RCH2OH).
Kwasowość
Zgodnie z definicją Brönsteda-Lowry'ego kwas jest taki, który przekazuje protony lub jony wodoru, h, h+. Kiedy dzieje się tak z alkoholem wtórnym, masz:
R2Choh + b- => R2Cho- + HB
Koniugate Ras2Cho-, Anion alkohotydenowy, twoje ujemne obciążenie musi ustabilizować. W przypadku alkoholu wtórnego stabilizacja jest niższa, ponieważ dwie grupy R mają gęstość elektroniczną, co do pewnego stopnia odpiera ujemne obciążenie atomu tlenu.
Tymczasem dla anionu alkoksydowego pierwotnego alkoholu, RCH2ALBO-, Istnieje mniej odpychania elektronicznego, które ma tylko jedną grupę R, a nie dwie. Ponadto atomy wodoru nie wykonują znacznego odpychania i wręcz przeciwnie, przyczyniają się do stabilizacji obciążenia ujemnego.
Dlatego alkohole wtórne są mniej kwaśne niż alkohole pierwotne. Jeśli tak jest, są one bardziej podstawowe i dokładnie z tych samych powodów:
R2Choh + H2B+ => R2Choh2+ + HB
Teraz grupy R stabilizują dodatnie obciążenie tlenu, dając część ich gęstości elektronicznej.
Reakcje
Hallogenid wodoru i trihalogened fosforu
Alkohol wtórny może reagować z halogenkiem wodoru. Równanie chemiczne reakcji między alkoholem izopropylowym a kwasem bromhyterowym pokazano w środku kwasu siarkowego i wytwarzającego bromek izopropylu:
Ch3Chohch3 + HBR => CH3Chbrch3 + H2ALBO
I możesz także reagować z trihalogenuero fosforu, PX3 (X = br, i):
Może ci służyć: wodorotlenek niklu (iii): struktura, właściwości, zastosowania, ryzykoCh3-Choh-ch2-Ch2-Ch3 + PBR3 => CH3-chbr-ch2-Ch2-Ch3 + H3PO3
Chemikalia powyżej odpowiada reakcji między odcinkiem a tribromidem fosforu, powodując bromek SEC-Pentil.
Należy zauważyć, że w obu reakcjach występuje wtórny alkilowo -halogenny (R2CHX).
Odwodnienie
W tej reakcji utracone są H i OH z sąsiednich węgli, tworząc podwójne wiązanie między tymi dwoma atomami węgla. Dlatego istnieje powstawanie alkenu. Reakcja wymaga kwasowego katalizatora i dopływu ciepła.
Alkohol => alkene + h2ALBO
Masz na przykład następującą reakcję:
Cykloheksanol => cykloheksen + h2ALBO
Reakcja z aktywnymi metaliami
Wtórne alkohole mogą reagować na metale:
Ch3-Choh-ch3 + K => Cho3Cho-K+Ch3 + ½ godz+
Tutaj alkohol izopropylowy reaguje z potasem z tworzeniem izoporlenku potasu i jonów wodoru.
Estryfikacja
Alkohol wtórny reaguje z kwasem karboksylowym, aby zacząć ester. Na przykład, równanie chemiczne reakcji alkoholu biodrowego jest pokazane z kwasem octowym, aby wytwarzać octan półbutylu:
Ch3Chohch2Ch3 + Ch3Cooh ch3Coochch3Ch2Ch3
Utlenianie
Pierwotne alkohole utleniają aldehydo, które z kolei utleniają kwasy karboksylowe. Ale alkohole wtórne utleniają aceton. Reakcje są zwykle katalizowane przez dichromian potasu (k2Cro7) i kwas chromowy (h2Cro4).
Globalna reakcja to:
R2Choh => r2C = O
Nomenklatura
Wtórne alkohole są wyznaczone przez wskazanie na pozycję grupy OH w głównym łańcuchu (dłużej). Ten numer poprzedza nazwę lub może przejść po nazwę odpowiedniego alkanów dla wspomnianego łańcucha.
Na przykład Cho3Ch2Ch2Ch2Chohch3, To jest 2-heksanol lub heksan-2-2-to.
Jeśli struktura jest cykliczna, nie ma potrzeby umieszczania licznika; chyba że są inni podstawieni. Właśnie dlatego cykliczny alkohol drugiego obrazu nazywa się cykloheksanol (pierścień jest sześciokątny).
Może ci służyć: aminyA dla drugiego alkoholu tego samego obrazu (rozgałęzionego) nazywa się: 6-etylo-heptan-2 -ol.
Aplikacje
-Sec-butanol jest używany jako rozpuszczalnik i pośrednia chemikalia. Jest obecny w płynach hydraulicznych dla hamulców, środków czyszczących przemysłowych, polerowania, kufla, minerałów flotacji oraz esencji owoce i perfum.
-Alkohol izopropanolu jest stosowany jako rozpuszczalnik przemysłowy i antykoagulant. Jest stosowany w olejach i szybkich suszących atramentach, takich jak antyseptyczny i substytut kosmetyków etanolu (na przykład: płyny skóry, tonik naczyń włosowatych i alkohol tarcia).
-Izopropanol jest składnikiem ciekłych mydeł, krystalicznych środków czyszczących, syntetycznych aromatyzatorów napojów niealkoholowych i żywności. Ponadto jest to pośrednia chemikalia.
-Cykloheksanol jest używany jako rozpuszczalnik, w wykończeniu tkanki, w przetwarzaniu mydeł skóry i emulgujących oraz syntetyczne detergenty.
-Metylcykloheksanol jest składnikiem produktów do żucia opartych na mydle i detergentach do specjalnych tkanek.
Przykłady
2-Octhanol
 Cząsteczka 2-ORTANOL. Źródło: Jü [domena publiczna], z Wikimedia Commons
Cząsteczka 2-ORTANOL. Źródło: Jü [domena publiczna], z Wikimedia Commons To tłuszczowy alkohol. Jest to bezbarwna ciecz, niewielka rozpuszczalna w wodzie, ale rozpuszczalna w większości rozpuszczalników nieolarnych. Jest stosowany między innymi w opracowaniu smaków i zapachów, obrazów i powłok, atramentów, klejów, opieki domowej i smarów.
Estradiol lub 17β-strradiol
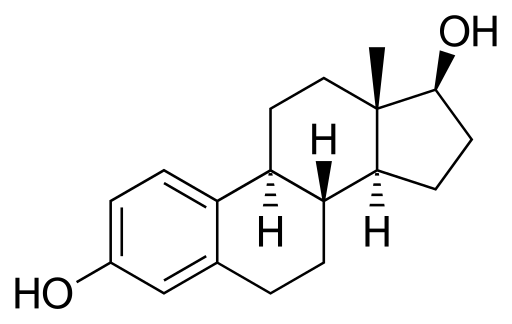 Cząsteczka estradiolu. Źródło: Neuropoger [domena publiczna], z Wikimedia Commons
Cząsteczka estradiolu. Źródło: Neuropoger [domena publiczna], z Wikimedia Commons Jest to hormon seksualny steryd. Ma dwie grupy hydroksylli w swojej strukturze. Jest to dominujący estrogen w latach reprodukcyjnych.
20-hydroksy-leukotriene
Jest to metabolit, który prawdopodobnie pochodzi z utleniania lipidu leukotrien. Jest klasyfikowany jako leukotriene cystinel. Związki te są mediatorami procesu zapalnego, który przyczynia się do patofizjologicznej cechy alergicznego zapalenia nosa.
2-heptanol
Jest to alkohol znajdujący się w owocach. Ponadto znajduje się w oleju imbiru i truskawkach. Jest przezroczysty, bezbarwny i nierozpuszczalny w wodzie. Jest stosowany jako rozpuszczalnik kilku żywic i interweniuje w fazie flotacji w przetwarzaniu minerałów.
Bibliografia
- Encyklopedia zdrowia i bezpieczeństwa w pracy. (S.F.). Alkohole. [PDF]. Odzyskane z: InSht.Jest
- Struktura i klasyfikacja alkoholi. Chemia librettexts. Odzyskane z: chem.Librettexts.org

