Adenilato Ciclas Charakterystyka, typy, funkcje
- 1994
- 124
- Maksymilian Kępa
Cyklasa adenylan albo adenylcyklaza Jest to enzym odpowiedzialny za konwersję ATP, cząsteczka o wysokiej energii, w cyklicznym wzmacniaczu, ważną cząsteczkę sygnalizacyjną, która aktywuje różne cykliczne białka AMP o ważnych funkcjach fizjologicznych.
Jego aktywność jest kontrolowana przez różne czynniki, takie jak skoordynowane działanie hormonów, neuroprzekaźników i innych cząsteczek regulacyjnych o różnym naturze (bilansowe jony wapnia i białka G, żeby wymienić tylko kilka).
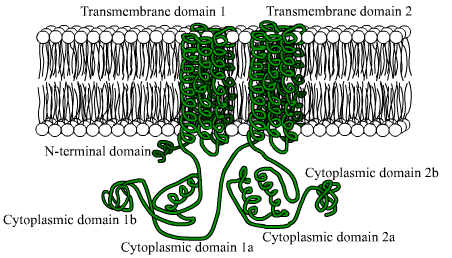
 Cyklasa Diagram adenylanowy (źródło: użytkownik BensAccount On.Wikipedia [domena publiczna] za pośrednictwem Wikimedia Commons)
Cyklasa Diagram adenylanowy (źródło: użytkownik BensAccount On.Wikipedia [domena publiczna] za pośrednictwem Wikimedia Commons) Główne znaczenie tego enzymu polega na transcendencji produktu reakcji, w której katalizuje, cykliczny wzmacniacz, ponieważ uczestniczy w kontroli wielu zjawisk komórkowych związanych z metabolizmem i rozwojem, a także w odpowiedzi na różne bodźce zewnętrzne.
W naturze zarówno organizmy jednokomórkowe (stosunkowo proste), jak i duże i złożone zwierzęta wielokomórkowe, używają cyklicznego wzmacniacza jako drugiego posłańca, a zatem do enzymów, które go wytwarzają.
Badania filogenetyczne wykazują, że enzymy te pochodzą od wspólnego przodka przed oddzieleniem eubakterii i eukariotów, co sugeruje, że cykliczny wzmacniacz miał różne funkcje, być może związane z produkcją ATP.
Możliwe jest zaakceptowanie takiego stwierdzenia, ponieważ reakcja katalizowana przez cyklazę adenilową jest łatwo odwracalna, co można zauważyć w stałej równowagi dla syntezy ATP (KEq ≈ 2.1 ± 0.2 10-9 M2).
[TOC]
Charakterystyka i struktura
Większość eukariotycznych enzymów adenylanowych cyklastowych jest związana z błoną plazmatyczną, ale w bakteriach i u ssaczych komórek nasienia występują jako rozpuszczalne białka w cytosol.
W drożdżach i niektórymi bakteriami są białka błony obwodowej, podczas gdy u niektórych gatunków ameby są cząsteczkami o pojedynczym segmencie transbłonowym.
Charakterystyka strukturalna
Są to białka złożone z dużych łańcuchów polipeptydowych (więcej niż 1.000 odpadów aminokwasowych), które przekraczają błonę plazmatyczną 12 razy za pomocą dwóch regionów złożonych z sześciu domen transmembranowych konformacji alfa.
Każdy obszar transbembranowy jest oddzielony dużą domeną cytosolową, która jest odpowiedzialna za aktywność katalityczną.
Może ci służyć: flora i fauna z Afryki: reprezentatywne gatunkiWśród organizmów eukariotycznych istnieją pewne powody zachowane w fragmencie regionu aminowego tych enzymów, a także domeny cytoplazmatycznej około 40 kDa, która jest ograniczona przez skrawki hydrofobowe.
Miejsce katalityczne
Reakcja, którą katone te enzymy, to znaczy tworzenie wiązania dietetycznego poprzez atak nukleofilowy grupy OH w pozycji 3 'do grupy fosforanowej trfosforanu nukleozydowego w pozycji 5', zależy od wspólnego motywu strukturalnego znanego jako The the Structural Motive Domena Palm ".
Ta domena „Palma” składa się z powodu ”βαβαβ„(” Β ”chęć oznaczania arkuszy β i„ α ”do śmigieł alfa) i ma dwie niezmienne reszty kwasu przy sparowatym, które koordynują dwa jony metali odpowiedzialne za katalizę, które mogą być białkowymi jonami magnezu lub jonów magnezu cynku.
Wiele badań związanych ze strukturą czwartorzędową tych enzymów ujawniło, że ich katalityczna jedność istnieje jako dimer, którego tworzenie zależy od segmentów transbłonkowych, które są gromadzone w retikulum endoplazmatycznym podczas tworzenia białka.
Lokalizacja
Ustalono, że podobnie jak wiele kompleksowych białek błonowych, takich jak białka G, te z kotwicami fosfatydyloinozytolowymi i wiele innych, adenylcyki znajdują się w regionach lub specjalnych mikro domenach błony znanych jako „balsas lipidowy” (angielskiej angielskiej „Tratwa lipidowa”).
Te domeny błonowe mogą mieć do setek nanometrów średnicy i składają się głównie z cholesterolu i sfingolipidów z głównie nasyconymi łańcuchami kwasów tłuszczowych i dużej długości, co powoduje, że mają mniej płynności i umożliwić pomieszczeniu segmentów transbembranowych różnych białek białek.
Adenil cyklasowy również stał się związany z podregionami tratw lipidowych znanych jako „Caveolas” (angielski ”Caveolae "), które są raczej inwaminacją błony bogatej w cholesterol i białko związane z tym, zwane caveolina.
Chłopaki
W naturze istnieją trzy rodzaje dobrze zdefiniowanych cyklasów adenylanowych i dwa, które są aktualne podlegające dyskusji.
Może ci służyć: oksyhemoglobina: Charakterystyka, struktura i krzywa związkowa- Klasa I: Są obecne w wielu bakteriach Gram -ujemnych, takich jak I. coli, Na przykład, gdzie cykliczny produkt AMP reakcji ma funkcje, takie jak ligand dla czynników transkrypcyjnych odpowiedzialnych za regulację operatów katabolicznych.
- Klasa II: znajdują się w niektórych patogenach gatunków bakterii, takich jak Bakcyl albo Bordetella, gdzie służą jako toksyny pozakomórkowe. Są to białka aktywowane przez gospodarza kalmodulinę (nieobecne w bakteriach).
- Klasa III: Są one znane jako klasa „uniwersalna” i są filogenetycznie powiązane z cyklazami guanilaato, które spełniają podobne funkcje. Znajdują się zarówno w prokariotach, jak i eukariotach, gdzie są regulowane przez różne drogi.
Cyklaza ssaków adenylanowych
U ssaków co najmniej dziewięć rodzajów tych enzymów zostało sklonowanych i opisanych.
Dzielą one złożone struktury i topologie membranowe, a także duplikaty domen katalitycznych, które są dla nich charakterystyczne.
W przypadku ssaków nomenklatura używana w odniesieniu do izoform odpowiada literom prądu przemiennego (przez Cyklasa adenylan) i do liczby od 1 do 9 (AC1 - AC9). Zgłoszono również dwa warianty enzymu AC8.
Izoformy obecne u tych zwierząt są odpowiednikiem pod względem sekwencji pierwotnej struktury ich miejsc katalitycznych i struktury trójwymiarowej. Włączenie jednego z tych enzymów do każdego „typu” jest głównie związane z mechanizmami regulacji, które działają na każdej izoformie.
Mają wzorce ekspresji, które często są specyficzne dla tkanki. W mózgu można znaleźć wszystkie izoformy, chociaż niektóre są ograniczone do określonych obszarów ośrodkowego układu nerwowego.
Funkcje
Główną funkcją enzymów należących do rodziny adenylanu Cylasa jest przekształcenie ATP w cykliczny wzmacniacz, a dla tego katalizują tworzenie wewnątrzcząsteczkowego dietetyka łącza 3 ' - 5' (podobna do tej katalizowanej przez polimerazy DNA), z polimerazami DNA), z polimerazami DNA), z polimerazami DNA), z polimerazami DNA) uwalnianie cząsteczki pirofosforanu.
U ssaków różne warianty, które można osiągnąć, zostały powiązane z proliferacją komórek, uzależnieniem od etanolu, plastyczności synaptycznej, uzależnieniem od leku, rytmem okołodobowym, stymulacją węchową, uczeniem się i pamięcią.
Może ci służyć: pasożytnictwo: koncepcja, typy i przykładyNiektórzy autorzy stwierdzili, że adenylan cyklazowy może mieć dodatkową funkcję, taką jak cząsteczki transportu lub, które są tym samym, białka kanału i przenośniki jonowe.
Jednak hipotezy te zostały udowodnione tylko w zależności od układu lub topologii transbranowych segmentów tych enzymów, które dzielą niektóre homologie strukturalne lub podobieństwa (ale nie sekwencję) z niektórymi kanałami transportowymi jonowymi.
Zarówno cykliczny wzmacniacz, jak i PPI (pirofosforan), które są produktami reakcji, mają funkcje na poziomie komórkowym; Ale jego znaczenie zależy od organizmu, gdzie są.
Rozporządzenie
Wielka różnorodność strukturalna między klawrom adenylosiowym pokazuje dużą podatność na wiele form regulacji, co pozwala im zintegrować się z różnymi komórkowymi trasami sygnalizacyjnymi.
Aktywność katalityczna niektórych z tych enzymów zależy od ketoacidów alfa, podczas gdy inne mają znacznie bardziej złożone mechanizmy regulacji, które obejmują podjednostki regulacyjne (przez stymulację lub hamowanie), które zależą na przykład od wapnia i innych czynników ogólnie rozpuszczalnych, a także innych, a także innych białka.
Wiele adenilów cyklasów jest negatywnie regulowanych przez podjednostki niektórych białek G (hamują ich funkcję), podczas gdy inni wywierają raczej aktywatory.
Bibliografia
- Cooper, d. M. F. (2003). Regulacja i organizacja cyklas i obozu adenylylowego. Journal Biochemical, 375, 517-529.
- Cooper, d., Mons, n., I Karpen, J. (1995). Cyklazy adenylowe i interakcja między wapniem a sigalingiem obozowym. Natura, 374, 421-424.
- Danchin, a. (1993). Filogeneza cyklas adenylil. Postęp w badaniach drugiego posłańca i fosfoprotein, 27, 109-135.
- Hanoune, J., & Defer, n. (2001). Regulacja i rola izoform cyklazy adenylowej. Ann. Obrót silnika. Farmakol. Toksyk., 41, 145-174.
- Granica, u., & Schultz, J. I. (2003). Cyklasy adenylilowe klasy III: moduły sygnalizacyjne wielofunkcyjne. Sygnalizacja komórkowa, piętnaście, 1081-1089.
- Tang, w., & Gilman, do. G. (1992). Cyklaza adenylowa. Komórka, 70, 669-672.
- « Dyfrakcja dźwięku, z którego składa się, przykłady, aplikacje
- Tło Santa Alliance, cele, konsekwencje »

