Struktura octanu sodu, właściwości, synteza,

- 3711
- 839
- Marianna Czarnecki
On Octan sodowy Jest sól sodową kwasu octowego, którego wzorem molekularnym wynosi C2H3ALBO2Na. Składa się z delikatnego białego proszku, obecnego zasadniczo w dwóch postaciach: bezwodnego i trójdrożu. Oba są bardzo rozpuszczalne w wodzie, uniwersalnym rozpuszczalnikiem; Ale nie tak rozpuszczalne w alkoholu lub acetonie.
Forma bezwodności ma gęstość, fuzję i temperaturę wrzenia o wyższych wartościach niż te przedstawione przez trójnower. Wynika to z faktu, że cząsteczki wody zakłócają interakcje jonów Na+ i rozdz3Gruchać-.
 Wygląd octanu sodu
Wygląd octanu sodu Octan sodu jest stabilny, szczególnie jeśli jest przechowywany między 2 a 8 ° C; Ale jest to podatne na działanie silnych środków utleniających i halogenów.
Można go przygotować przez reakcję wodorowęglanu sodu z kwasem octowym. Również w przypadku reakcji kwasu octowego z wodorotlenkiem sodu. Obie reakcje są łatwe do rozwinięcia i niskie koszty ekonomiczne; Pierwszy nawet można zrobić w domu.
Ta sól jest trochę toksycznym związkiem. Powoduje podrażnienie skóry, dopiero po częstym i ciągłym kontaktowi. To jest mało irytujące dla oczu, ale może podrażniać drogi oddechowe. Nie ma informacji o szkodliwym efekcie spożycia.
Ma wiele zastosowań i zastosowań, podkreślając jego funkcję tłumienia pH wraz z kwasem octowym. Absorbnik wstrząsu octanu ma PKA = 4,7; który zapewnia wysoką wydajność w regulacji pH w środowisku kwaśnym o wartościach pH między 3 a 6.
Ze względu na niską toksyczność i właściwości, był szeroko stosowany w celu zwiększenia smaku żywności, a także agenta, który zapewnia ochronę przed rozkładem ze względu na ich działanie przed drobnoustrojami.
[TOC]
Struktura octanu sodu
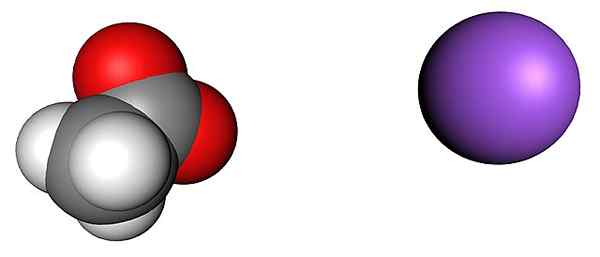 Jony octanu i sodu. Źródło: Shu0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Jony octanu i sodu. Źródło: Shu0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Górny obraz pokazuje jony tworzące bezwodne kryształy octanu sodu (bez wody). Fioletowa kula odpowiada kationowi+, A jon molekularny po jego lewej stronie jest octanem, cho3Gruchać-, Z atomami tlenu reprezentowanymi przez czerwone kule.
Ci rówieśnicy, zgodnie z chipem CH3Ścieżka, ma proporcję 1: 1; Dla każdego Cho3Gruchać-, Musi być kation+ przyciągany przez ujemne obciążenie i odwrotnie. Zatem atrakcje między nimi i odpychami między równymi obciążeniami, ustanawiają wzorce strukturalne, które definiują kryształ, którego minimalna ekspresja jest komórką jednolitą.
Ta jednolita komórka, podobnie jak szkło jako całość, zmienia się w zależności od rozmieszczenia jonów w przestrzeni; Nie zawsze jest tak samo, nawet w przypadku tego samego układu krystalicznego. Na przykład bezwodny octan sodu może tworzyć dwa polimorfy ortorbiebowe, z których jeden przedstawiono poniżej:
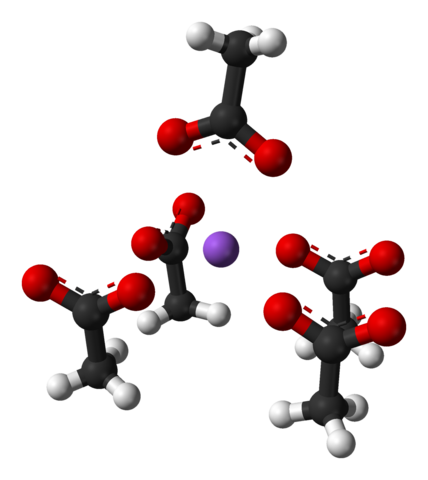 Jednolita komórka kryształów octanu sodu. Źródło: Benjah-BMM27 [domena publiczna]
Jednolita komórka kryształów octanu sodu. Źródło: Benjah-BMM27 [domena publiczna] Zwróć uwagę na układ jonów: cztery jony cho3Gruchać- Załączają na+ w taki sposób, że „rysują” zniekształconą kwadratową piramidę. Każdy z tych Cho3Gruchać- z kolei wchodzą w interakcje z innym na+ przylegający.
Nawilżone kryształy
Octan sodu ma duże powinowactwo do wody; W rzeczywistości jest pyszne, to znaczy zachowuje wilgoć, aż się rozpuści w tym samym. Im większa wilgoć, wcześniej „topi się”. To dlatego, że tak3Gruchać- Jak na+ Mogą nawodnić, otaczać się cząsteczkami wody, które kierują dipolami w kierunku ich ładunków (na+ Oh2, Ch3Gruchać- Hoh).
Może ci służyć: srebrny bromek (AGBR): struktura, właściwości i zastosowaniaGdy sól jest przygotowywana w laboratorium lub w domu, jest to takie powinowactwo do wody, że nawet w normalnych temperaturach jest już uzyskiwane jako hydrat; Ch3Pata · 3H2ALBO. Ich kryształy przestają być ortorombowe i stają się monokliniczne, ponieważ teraz zawierają trzy cząsteczki wody dla każdej pary Cho3Gruchać- i na+.
Nieruchomości
Nazwy
-Octan sodowy.
-Etanoan sodu (IUPAC).
Masa cząsteczkowa
-Bezwodne: 82,03 g/mol.
-Trihydred: 136,03 g/mol.
Aspekt
Delikatny biały proszek.
Zapach
Do octu, gdy jest ogrzewany do rozkładu.
Gęstość
-Anhidro: 1, 528 g/cm3 w 20 ° C.
-Trihydred: 1,45 g/cm3 w 20 ° C.
Temperatura topnienia
-Anhidro: 324 ºC (615 ºF, 597 K).
-TRIOHYRAN: 58 ° C (136 ºF, 331 K).
Punkt wrzenia
-Anhidro: 881,4 ºC (1.618,5 ºF, 1.154,5 K).
-Trihydrat: 122 ° C (252 ºF, 395 K). Rozkłada się.
Rozpuszczalność
W wodzie
-Anhydro: 123,3 g/100 ml w 20ºC.
-Trihydred: 46,4 g/100 ml w 20 ° C.
W metanolu
16 g/100 g w 15 ° C.
W etanolu
5,3 g/100 ml (trihydrat).
W acetonie
0,5 g/kg w 15 ° C.
Kwasowość
PKA: 24 (20 ° C).
Zasadowość
PKB: 9.25. Tutaj oczywiste jest, że octan sodu jest podstawową solą, ponieważ konieczne jest posiadanie PKB mniej niż jego PKA.
Wskaźnik refrakcji (ηd)
1 464
Pojemność kaloryczna
-100,83 J/mol · k (bezwodny).
-229,9 J/mol · K (Trihydrado).
punkt zapłonu
Ponad 250ºC.
Temperatura samowystarczalności
600 ° C.
Ph
8,9 (roztwór 0,1 m do 25 ° C).
Stabilność
Stabilny. Niezgodne z silnymi i halogenowymi środkami utleniającymi. Wilgoć.
Reakcje
Octan sodu może tworzyć ester, reagując z halogenkiem wynajmu; Na przykład bromoetano:
Ch3Poron +brch2Ch3 => Ch3Cooch2Ch3 + Nabr
Octan sodu to dekarboksyla, tworząc metan (piroliza) w obecności NaOH:
Ch3Poon +naoh => ch4 + Na2WSPÓŁ3
Reakcja jest katalizowana przez sprzedaż Cesio.
Synteza
Octan sodu może być wytwarzany po niskich kosztach w laboratorium poprzez reakcję wodorowęglanu sodu kwasem octowym:
Nahco3 + Ch3Cooh => ch3Ścieżka +h2WSPÓŁ3
Ta reakcji towarzyszy obecność w roztworze intensywnego pęcherza, z powodu rozkładu kwasu węglowego w wodzie i dwutlenku węgla.
H2WSPÓŁ3 => H2Lub +co2
Industralnie octan sodu jest wytwarzany przez reakcję kwasu octowego z wodorotlenkiem sodu.
Ch3Cooh +naoh => ch3Ścieżka +h2ALBO
Aplikacje
Torby termiczne
Do produkcji toreb termicznych stosuje się octan sodu.
Początkowo kryształy soli rozpuszczane są w objętości wody w celu przygotowania roztworu, który zostaje przesycony.
Następnie podgrzewa się roztwór w temperaturze większej niż 58 ° C. Roztwór przesyconego w temperaturze pokojowej może się chłodzić, a tworzenie kryształów nie jest obserwowane; Rozwiązanie jest przesadzone.
Może ci służyć: okresowy stół, po co to jestBrak kryształów wyjaśniono, że cząsteczki ciekłe są zbyt nieuporządkowane i nie mają należytej wskazówek w celu osiągnięcia temperatury krystalizacji. Ciecz jest w stanie metastabilnym, stan nierównowagi.
Dawać. W przypadku worków termicznych przyciska się mechaniczne przycisk, aby wymieszać ciecz i zainicjować tworzenie kryształów i zestalanie trójstronnego roztworu octanu sodu.
W miarę występowania krystalizacji temperatura rośnie. Trihydred Crystals sodu octanu nabierają lodu, ale są gorące, więc nazywa się to „gorącym lodem”.
Przemysłowcy
-Octan sodu jest stosowany w przemyśle tekstylnym jako mordant w procesie barwienia tkanek
-Zneutralizuj odpady kwasu siarkowego
-Ma zastosowanie w przetwarzaniu bawełny do opracowania bawełnianych podkładek, użytecznych w osobistym czyszczeniu i do celów medycznych
-Jest używany w metalowej marynbie, zanim jest chromowany
-Współpracuje, aby wulkanizacja chloroprenu nie występowała w procesie produkcji gumy syntetycznej
-Interweniuje w oczyszczaniu glukozy
-Jest używany w opalaniu skór.
Użycie medyczne
Octan sodu jest częścią związków stosowanych do dostarczania elektrolitów podawanych pacjentom.
Służy do skorygowania poziomów sodu u pacjentów z podskórnym, również w korekcie kwasicy metabolicznej i alkalizacji moczu.
Roztwór tłumienia pH
Jest stosowany jako regulator pH w wielu reakcjach enzymatycznych, które występują między pH 3 i pH 6.
Różne pH roztworu buforu octanu osiąga się przez zmianę stężenia kwasu octowego i octanu sodu.
Na przykład, aby uzyskać pH 4,5 roztwór bufora ma stężenie kwasu octowego 3,8 g/l i stężenie bezwodnego octanu sodu wynoszącego 3,0 g/l.
Stężenie roztworu buforu octanu można zwiększyć, zwiększając się w tej samej proporcji składniki roztworu niezbędnego do uzyskania pożądanego pH.
Absorbera amortyzatora octanu/acetonitrylu jest stosowana w elektroforezy kapilarnej w separacji fotobberberiny.
Laboratoria badawcze
-Octan sodu jest słabym środkiem nukleofilowym stosowanym w polimeryzacji anionowej β-laktonu.
-Jest stosowany jako odczynnik w jądrowym rezonansie magnetycznym biologicznych makrocząsteczek.
-Jest stosowany w ekstrakcji komórek komórek. Sód jest kationem, który oddziałuje z ujemnym obciążeniami fosforanów obecnych w DNA, co pomaga w jego kondensacji. W obecności etanolu DNA tworzy osad, który można następnie podzielić na warstwę wodną.
Ochrona żywności
-Pomaga zapobiegać wzrostowi bakterii, oprócz zapobiegania wytwarzaniu nadmiernej kwasowości, która powoduje pogorszenie żywności, utrzymując w ten sposób określone pH.
-Sód obecny w octanie poprawia smak żywności.
-Octan sodu jest stosowany w przygotowaniu marynatów warzywnych: ogórek, marchwi, cebuli itp. Ponadto jest stosowany w ochronie mięsa.
Może ci służyć: dimetyloinę: struktura, właściwości, synteza, zastosowaniaOchrona betonu
Beton jest uszkodzony przez działanie wody, która skraca jej czas trwania. Octan sodu działa jak betonowy środek uszczelniający, który wodoodportuje go do wody, przedłużając jego początkowe cechy.
Młode eksperymenty
Eksperyment 1
Prostym eksperymentem jest synteza octanu sodu poprzez reakcję wodorowęglanu sodu z octem (5%kwasu octowego).
30 ml octu umieszcza się w zlewce i dodaje się około 3,5 g wodorowęglanu.
W reakcji powstaje postacie sodu i kwasu węglowego. Kwas jest podzielony na dwutlenek węgla i wodę. Wytwarzanie dwutlenku węgla spowoduje intensywną bańkę w roztworze.
Aby zebrać octan sodu, spowodowane jest odparowanie wody, ogrzewanie roztworu.
Eksperyment 2
Kolejnym prostym eksperymentem jest tworzenie octanu trihydratu sodu.
Aby to zrobić, około 20 g octanu sodu trójnastanu i umieszczonego w zlewce, a następnie dodanie 10 ml wody, a następnie dodanie 10 ml wody. Roztwór ogrzewa się do temperatury większej niż 58 ° C.
Octan sodu jest całkowicie rozpuszczony, aby upewnić się, że roztwór jest przesycany. Wcześniej na zimnej powierzchni umieszcza się kapsułka Pietri.
Zawartość zlewki z trójnownate octan w kapsułce Pietri jest powoli wylewana. Temperatura cieczy w kapsułce zaczyna schodzić, nawet pod temperaturą topnienia, bez obserwowania krystalizacji lub zestalania octanu sodu trójnowotarowego.
Zazwyczaj do wytworzenia krystalizacji trójdlanego octanu sodu, dodaje się niewielką ilość soli, aby służyć jako rdzeń krystalizacji. Innym razem występuje niewielkie zaburzenia roztworu, aby zainicjować krystalizację octanu sodu.
Trójdrowe kryształy octanu sodu wyglądają jak lód, ale jeśli zostaną dotknięte, zostanie zauważone, że są stosunkowo gorące. Z tego powodu sól nazywa się „gorącym lodem”.
Toksyczność
Octan sodu jest bardzo małym toksycznym związkiem. Nie jest też klasyfikowany jako czułość dla skóry i drogi oddechowych.
Ponadto octan sodu nie jest klasyfikowany jako środek mutagenowy w zarodkach, rakotwórczych lub toksycznych komórkach do reprodukcji.
Krótko mówiąc, jest to mało irytujące dla oczu. Drogi oddechowe mogą być zirytowane po ich wdychaniu. Częste i stały kontakt ze skórą może powodować jej podrażnienie.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Worldofchemicals. (16 stycznia 2017 r.). Jak przygotować octan sodu w domu? Odzyskane z: medium.com
- National Center for Biotechnology Information. (2019). Octan sodowy. Baza danych Pubchem. CID = 517045. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- S. Cameron, k. M. Mannan i m. ALBO. Rahman. (1976). Struktura krystaliczna trójnoweru octanu sodu. Crysta Act. B32, 87.
- Wikipedia. (2019). Octan sodowy. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (24 stycznia 2019). Zrób gorący lód z octu i sody oczyszczonej. Odzyskane z: Thoughtco.com
- Książka chemiczna. (2017). Octan sodowy. Odzyskany z: chemicalbook.com
- Wasserman Robin. (2019). Zastosowania octanu sodu. Odzyskane z: Livestrong.com
- Bank narkotykowy. (2019). Octan sodowy. Wyjazd z: Banku Drug.AC

