50 przykładów kwasów i podstaw

- 4034
- 713
- Arkady Sawicki
Są setki Przykłady kwasów i podstaw które można znaleźć we wszystkich gałęziach chemii, ale to jako całość są one podzielone na dwie duże rodziny: nieorganiczne i organiczne. Kwasy nieorganiczne są zwykle znane jako kwasy mineralne, charakteryzujące się szczególnie silnymi w porównaniu z organiczną.
Kwasy i zasady są rozumiane jako substancje, które mają odpowiednio smaki agriczne lub saponáceos. Oba są żrące, chociaż słowo „żrące” jest zwykle używane do silnych podstaw. W relacjach podsumowujących: spalają się i biegają po skórze, jeśli ją dotkną. Jego cechy w rozpuszczalnych mediach zaplanowały serię definicji w całej historii.
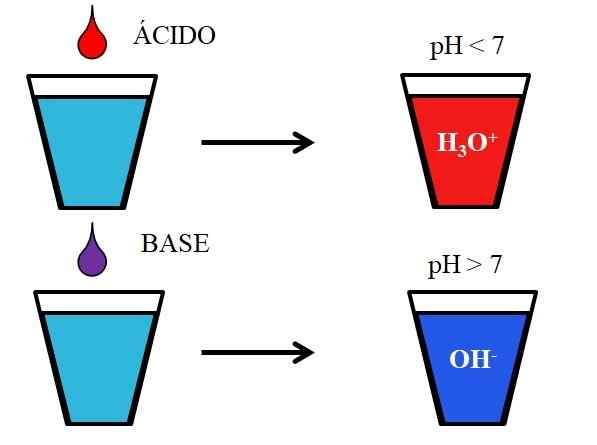 Zachowanie kwasów i zasad po rozpuszczeniu w wodzie. Źródło: Gabriel Bolívar.
Zachowanie kwasów i zasad po rozpuszczeniu w wodzie. Źródło: Gabriel Bolívar. Niższy obraz pokazuje ogólne zachowanie kwasów i zasad, gdy są one dodawane lub rozpuszczane w szklance z wodą. Kwasy wytwarzają roztwory o wartościach pH poniżej 7 z powodu jonów hydronios, h3ALBO+; Podczas gdy zasady wytwarzają roztwory o pH powyżej 7 z powodu jonów hydroksylowych (lub tlenku), OH-.
Jeśli dodamy kwas hydrochlorowy, HCL (czerwony kropla) do szkła, będą h jony3ALBO+ i Cl- nawilżone. Z drugiej strony, jeśli powtórzymy eksperyment z wodorotlenkiem sodu, NaOH (fioletowa kropla), będziemy mieli jony OH- i na+.
[TOC]
Definicje

Charakterystyka, coraz częściej badana i rozumiana, kwasów i zasad ustanawia więcej niż jedną definicję tych związków chemicznych. Wśród tych definicji mamy definicje Arrheniusa, definicje Bronsted-Lowry, a wreszcie Lewisa. Przed powołując się na przykłady, konieczne jest posiadanie tego jasnego.
Arrhenius
Kwasy i zasady, według Arrheniusa, to te, które rozpuszczały się w wodzie, wytwarzają h jony3ALBO+ lub och-, odpowiednio. To znaczy, obraz już reprezentuje tę definicję. Jednak sam w sobie gardzi zbyt słabymi kwasami lub zasadami, aby wyprodukować takie jony. W tym momencie wchodzi definicja Bronsteda-Lowry.
Może ci służyć: kwasy: cechy i przykładyBronsted-Lowry
Kwasy Bronsted-Lowry to te, które mogą przekazywać jony h+, A podstawy to te, które akceptują te H+. Jeśli kwas bardzo łatwo przekazuje+, Oznacza to, że jest to silny kwas. To samo dotyczy baz, ale akceptowanie h+.
Zatem mamy silne lub słabe kwasy i zasady, a ich siły są mierzone w różnych rozpuszczalnikach; zwłaszcza w wodzie, z której ustalono znane jednostki pH (od 0 do 14).
Dlatego silny kwas całkowicie przekazuje swój h+ do wody w reakcji tego typu:
Ha + h2O => a- + H3ALBO+
Gdzie- Jest to skoniugowana podstawa HA. Stąd przychodzi H3ALBO+ obecne w szkle z roztworem kwasu.
Tymczasem słaba baza B nie poprowadzi wody, aby uzyskać odpowiednią h+:
B + H2Lub HB + OH-
Gdzie Hb jest skoniugowanym kwasem B. Tak jest w przypadku amoniaku, NH3:
NH3 + H2Lub NH4+ + Oh-
Bardzo silna baza może bezpośrednio przekazać jony OH- Nie trzeba reagować z wodą; Jak w przypadku naoh.
Chwytak
Wreszcie, kwasy Lewisa to te, które wygrywają lub akceptują elektrony, a podstawy Lewisa to te, które przekazują lub tracą elektrony.
Na przykład bronsted-Lowry NH3 Jest to również podstawa Lewisa, ponieważ atom azotu akceptuje H+ Przekazując to ich pary wolnych elektronów (h3N: h+). Właśnie dlatego trzy definicje nie zgadzają się ze sobą, ale przeplatają się i pomagają w badaniu kwasowości i zasadowości w szerszym spektrum związków chemicznych.
Może ci służyć: nikiel: historia, właściwości, struktura, zastosowania, ryzykoPrzykłady kwasów
Wyjaśniając definicje, seria kwasów zostanie wspomniana poniżej z ich odpowiednimi formułami i nazwami:
-HF: kwas fluorowy
-HBR: kwas bromhydowy
-Cześć: kwas jodhydowy
-H2S: Kwas sulfhydowy
-H2SE: Kwas seleenhydowy
-H2TE: kwas telurowy
Są to kwasy binarne, zwane także hydraceidami, które należy do wyżej wspomnianego kwasu chlorowodorowego, HCL.
-Hno3: kwas azotowy
-Hno2: Kwas azotowy
-HNO: Kwas hiponitowy
-H2WSPÓŁ3: Kwas węglowy
-H2WSPÓŁ2: kwas carbonoso, który jest w rzeczywistości bardziej znany pod nazwą kwasu mrówkowego, HCOOH, najprostszego kwasu organicznego ze wszystkich
-H3PO4: Kwas fosforowy
-H3PO3 lub h2[HPO3]: kwas fosforowy z wiązaniem H-p
-H3PO2 lub h [h2PO2]: kwas hipofosferyczny z dwoma wiązaniami H-P
-H2południowy zachód4: Kwas Siarkowy
-H2południowy zachód3: Kwas siarkowy
-H2S2ALBO7: kwas dwusiarczkowy
-Hio4: kwas okołowy
-Hio3: Kwas jodowy
-Hio2: kwas jodozowy
-Hio: Hypoyodoso Acid
-H2Cro4: kwas chromowy
-Hmno4: Kwas manganiczny
-Ch3COOH: kwas octowy (ocet)
-Ch3południowy zachód3H: Kwas metanosulfonowy
Wszystkie te kwasy, z wyjątkiem mrówki i ostatnich dwóch, są znane jako Oxácidos lub kwasy trójskładnikowe.
Inni:
-Alcl3: chlorek aluminiowy
-Fecl3: Chlorek żelaza
-Bf3: Boro Trifluoruro
-Metalowe kationy rozpuszczone w wodzie
-Karbokacje
-H (CHBjedenaścieCljedenaście): Super kwaśny karboran
- Fso3H: kwas fluorosulfonowy
- HSBF6: Kwas fluoroantimoniczny
- Fso3H · sbf5: Magic Acid
Ostatnie cztery przykłady stanowią przerażające super kwasy; Związki zdolne do rozpadu prawie każdego materiału z ledwo go dotykającym. ALCL3 Jest przykładem kwasu Lewisa, ponieważ aluminiowe centrum metalu jest w stanie przyjmować elektrony ze względu na jego niedobór elektroniczny (nie uzupełnia jego oktetu Valencia).
Może ci służyć: wodorotlenek rtęci: struktura, właściwości, zastosowania, ryzykoPrzykłady baz
Wśród zasad nieorganicznych mamy wodorotlenki metalu, takie jak wodorotlenek sodu, i niektóre hydurny molekularne, takie jak już cytowane amoniak. Oto inne przykłady baz:
-Koh: wodorotlenek potasu
-Lioh: wodorotlenek litu
-RBOH: wodorotlenek Rubidio
-CSOH: wodorotlenek cezu
-Froh: Wodorotlenek Francio
-Być (oh)2: wodorotlenek berylowy
-Mg (OH)2: wodorotlenek magnezu
-CA (OH)2: wodorotlenek wapnia
-SR (OH)2: Wodorotlenek strontu
-BA (OH)2: wodorotlenek baru
-RA (OH)2: wodorotlenek radiowy
-Wiara (OH)2: wodorotlenek żelaza
-Wiara (OH)3: wodorotlenek żelazowy
-AL (OH)3: wodorotlenek aluminiowy
-PB (OH)4: Plúmbic wodorotlenek
-Zn (OH)2: wodorotlenek cynku
-CD (OH)2: wodorotlenek kadmu
-Cu (OH)2: Wodorotlenek miedzi
-Ti (OH)4: Wodorotlenek tytaniczny
-Ph3: fosfina
-Popiół3: Arsina
-Nanh2: sód Amiduro
- C5H5N: pirydyna
-(Ch3) N: trimetyloamina
- C6H5NH2: Fenyloamina lub anilin
-Nah: wodorek sodu
-KH: Wodorek potasu
-Carbaniony
-Li3N: azotek litowy
-Alcoxides
-[(Ch3)2CH]2NLI: diizopropilamid litu
-Dietinilbenzene Anion: C6H4C42- (najsilniejsza jak dotąd znana baza)
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Naomi Hennah. (10 października 2018 r.). Jak uczyć kwasów, baz i soli. Odzyskane z: edu.RSC.org
- Helmestine, Anne Marie, pH.D. (31 sierpnia 2019). Wzory wspólnych kwasów i zasad. Odzyskane z: Thoughtco.com
- David Wood. (2019). Porównaj wspólne kwasy i podstawy. Badanie. Odzyskane z: Study.com
- Ross Pomeroy. (23 sierpnia 2013). Najsilniejsze kwasy na świecie: jak ogień i lód. Odzyskane z: realCearScience.com
- Wikipedia. (2019). Dietynylobenzene dianion. Źródło: w:.Wikipedia.org
- « Symbole i formuły średnicy, jak to wyjąć, obwód
- Ekofizjologia Jakie badania i zastosowania u zwierząt i warzyw »

