Aromatyczny mechanizm podstawienia elektrofilowego i przykłady

- 686
- 89
- Herbert Wróblewski
Aromatyczne podstawienie elektrofilowe (SEAR) Jest to reakcja organiczna, w której słaby gatunek w elektronach, to znaczy elektropa, zastępuje jeden z hydrogenów aromatycznego pierścienia. Ta reakcja jest przeciwna dodatkom cierpiącym przez alkeny, wykazując wpływ aromatyczności na reaktywność benzenu i jego pochodnych.
Wielokrotnie elektrofil jest wytwarzany podczas tego samego mechanizmu molekularnego, produktu mieszaniny odczynników i katalizatora, który składa się z kwasu Lewisa, na przykład wszystkie3 lub FECL3. Te katalizatory zwiększają chciwość elektrofilów przez elektrony pierścienia aromatycznego, tym samym przyspieszając reakcję.
 W aromatycznym podstawieniu elektrofilowym to pierścień benzenowy atakuje elektrofil. Źródło: Gabriel Bolívar przez Molview.
W aromatycznym podstawieniu elektrofilowym to pierścień benzenowy atakuje elektrofil. Źródło: Gabriel Bolívar przez Molview. Na lepszym obrazie mamy prostą reprezentację elektrofilowego ataku benzenu w kierunku elektrofilów i+. Zauważ, że atak pochodzi z elektronów jednego z jego podwójnych wiązań; to znaczy, to elektrony sprzężonego układu π uruchamiają się.
Ta reakcja pozwala benzenowi i inne związki aromatyczne na pozyskiwanie podstawników, takich jak grupy OH, nie2, południowy zachód3H, Cl, Br, R, Cor, Coch3, pośród innych. Na przykład fenol jest syntetyzowany przez Sear, zaczynając od benzenu i innych pochodnych.
[TOC]
Aromatyczny mechanizm podstawienia elektrofilowego
Krok 1: Atak elektrofiliczny
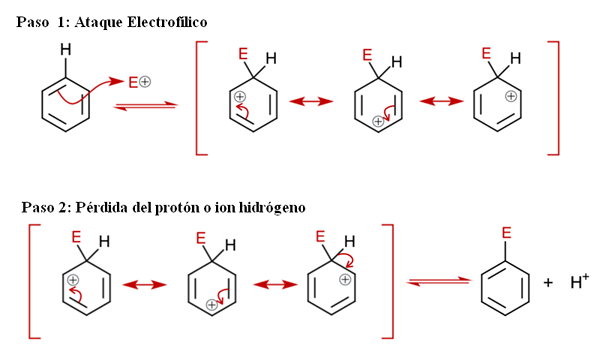 Ogólny mechanizm Sear. Źródło: Soonlorpai przez Wikipedia.
Ogólny mechanizm Sear. Źródło: Soonlorpai przez Wikipedia. Na obrazie wyższym mechanizm aromatycznego podstawienia elektrofilowego jest bardziej szczegółowo reprezentowany. Każde z trzech podwójnych wiązań benzenu atakuje elektrofil i+, Aby utworzyć gatunki pośrednie znane jako Ion Arenio (delokalizowany cykloheksadien), zamknięty w czerwonych nawiasach.
Może ci służyć: opady chemiczneZauważ, że dodatnie obciążenie E+ Teraz przejdź do wnętrza pierścienia. Ale nie tylko: przenosi się między trzema atomami węgla w pozycjach orto (sąsiadujących) i dla (przeciwnego) z węglem powiązanym z E (C-E). Ten pośrednik istnieje precyzyjnie dzięki stabilności przyznanej przez jego struktury rezonansowe.
Krok 2: Utrata protonu lub jonu wodoru
Jednak jon arenio musi wkrótce zneutralizować jego dodatnie obciążenie, utraty protonu lub jonu wodoru. Tutaj kończy się kulminacja zastępcza. Elektrofil e+ Dlatego zastępuje jeden z hydrogenów benzenowych, pozostawiając to jako jon h+ poza pierścieniem, aby zachowane są ładunki dodatnie.
Jeśli jest obserwowane ostrożnie, wszystkie kroki są w równowadze, więc wymiana jest odwracalna. To znaczy, jeśli stężenia H są zwiększone+, wtedy wodór zastąpi e i ponownie uzyskamy odczynniki.
Przykłady aromatycznej podstawienia elektrofilowego
Benzen
Benzen Sear jest najprostszy ze wszystkich, już przedstawiony powyżej. Każdy z hydrogenów można zastąpić E+, Ponieważ wszystkie są chemicznie równoważne.
Nie ma różnic od siebie. Dlatego prawdopodobieństwo, że wymiana występuje w jednym z sześciu atomów węgla, jest takie samo. Jednak wszystko się zmienia, gdy na pierścieniu benzenicznym występują inni podstawieniom, jak zobaczymy poniżej.
Fenol
Ortho, i ataki bramkowe
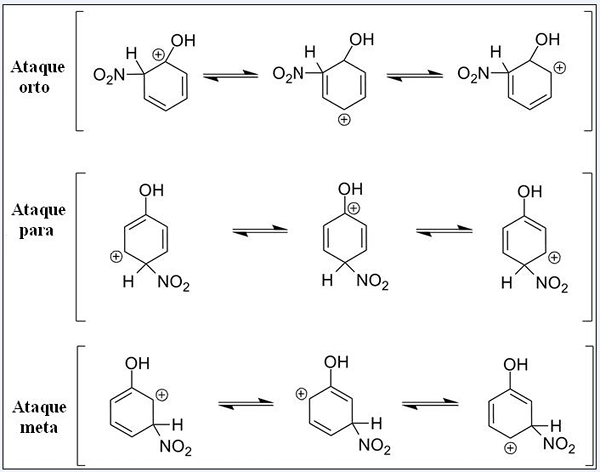 Struktury rezonansowe fenolu w aromatycznej reakcji elektrofilowej podstawowej. Źródło: Pete Davis, domena publiczna, przez Wikimedia Commons
Struktury rezonansowe fenolu w aromatycznej reakcji elektrofilowej podstawowej. Źródło: Pete Davis, domena publiczna, przez Wikimedia Commons Zastanów się teraz nad fenolem. Tym razem elektreza jest kationą nitroniczną, nie2+, które po linku z pierścieniem benzenowym jest przekształcane w grupę nitro, -no2.
Może ci służyć: azotany: właściwości, struktura, nomenklatura, szkolenieTeraz, gdy obecna jest grupa OH, pozostałe hydrogeny przestają chemicznie równoważne; Niektóre są bardziej podatne na zastąpienie niż inne. A ponadto OH wywiera w tym momencie bezpośredni wpływ.
W górę mamy trzy substytucje w różnych pozycjach związanych z OH: Ataki orto, za i cel. Zauważ, że we wszystkich trzech mamy piaszczystą kation i jego struktury rezonansowe. W atakach orto i dla obciążenia dodatnie wewnątrz pierścienia benzenu znajduje się tuż w węglu połączonym z OH; Podczas ataku docelowego tak się nie dzieje.
Och, jako grupa ortho i dla reżysera
OH przedstawia zdolność do ustępowania elektronów do pierścienia poprzez rezonans i indukcję. W obu może pomóc „rozproszyć” obciążenie dodatnie w węglu, z którym jest połączone, stabilizując odpowiednio strukturę. Przeciwnie, gdy nastąpi atak docelowy, OH nie może ustabilizować dodatniego obciążenia w ten sam sposób, struktura jest bardziej niestabilna.
Dlatego orto atakują i za więcej energii faworyzowane. Następnie mówi się, że OH jest grupą reżyserską orto-for, która może również aktywować pierścień benzeniczny w kierunku Sear. Oznacza to, że fenol reaguje znacznie szybciej niż benzen, co pokazuje się przez pomiar prędkości reakcji.
Arilaminy
 Struktury rezonansowe anilinę w jej aromatycznej reakcji elektrofilowej podstawowej. Źródło: V8rik w angielskiej Wikipedii, CC BY-SA 3.0, Via Wikimedia Commons
Struktury rezonansowe anilinę w jej aromatycznej reakcji elektrofilowej podstawowej. Źródło: V8rik w angielskiej Wikipedii, CC BY-SA 3.0, Via Wikimedia Commons Przypadek arilaminy, taki jak anilina (obraz wyższy), jest podobny do przypadku fenolu. Zauważ, że w swoim mechanizmie tym razem stabilizacja dodatniego obciążenia atomem azotu (H2N+=), pomoc w ustaleniu zastąpienia w kierunku pozycji orto i dla OH.
Może ci służyć: teorie kwasowo-basowe: Arrhenius, Bronsted-Lowry, LewisTeraz anilina jest bardziej reaktywna niż fenol w stosunku do podstawienia elektrofilowego. Ponieważ? Ponieważ atom azotu jest mniej elektroonywalny niż tlen, dlatego łatwiej daje pary wolnych elektronów. Tlen, ponieważ jest bardziej elektroongeneracyjny, daje jedną ze swoich par elektronów z mniejszą „chęcidnością”.
Również promień atomowy azotu jest bliższy rozmiarowi węgla. Ma to wpływ na fakt, że rezonans ma miejsce, szczególnie między atomami o podobnych radiotelefonach lub rozmiarach. Dlatego rezonans między węglem a azotem jest nieco bardziej stabilny i wydajny niż ten między węglem a tlenem.
Chlorobenzen
Z drugiej strony w chlorobenzen. I chociaż jest również w stanie przekazać elektronom z powodu rezonansu na pierścień, jego promień atomowy jest znacznie większy niż w przypadku węgla, a zatem zmniejszając wspomniany wkład elektroniczny.
W odpowiedzi chlorobenzen reaguje 50 razy wolniej niż benzen, ponieważ jego pierścień jest dezaktywowany z powodu chloru. A także przyciąganie elektronów do siebie, chlor jest grupą docelową, więc podstawienia wystąpią głównie w tej pozycji.
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Związek aromatyczny. Źródło: w:.Wikipedia.org
- Ed Vitz i in. (8 września 2020). Aromatyczne węglowodory. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Wyman Elizabeth. (2020). Aromatyczne węglowodory: definicja, przykład i użycie. Badanie. Odzyskane z: Study.com
- Boluda, c. J., Macías, m., I González Marrero, J. (2019). Złożoność chemiczna benzyny samochodowej. Nauka, inżynieria i zastosowania,2(2), 51-79. Doi: doi.Org/10.22206/Cyap.2019.V2i2.PP51-79
- « Charakterystyka energii cieplnej, uzyskiwanie, transfer
- Struktura tlenku aluminium, właściwości, zastosowania, nomenklatura »

