Historia selenu, właściwości, struktura, uzyskiwanie, użycie

- 1292
- 265
- Filip Augustyn
On selen Jest to nie -metalowa substancja chemiczna, która należy do grupy 16 tabeli okresowej i jest reprezentowana przez symbol. Ten element ma pośrednie właściwości między siarką a telurio, które są członkami tej samej grupy.
Selen został odkryty w 1817 roku przez Jöhs J. Berzelius i John G. Gahn, który odparował piryt zaobserwował czerwoną resztę (niższy obraz). Na początku pomylili go z telurio, ale potem zdali sobie sprawę, że stoją przed nowym elementem.
 Butelka z amorficznym czerwonym selenem, najbardziej znanym wolnym dla tego elementu. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Butelka z amorficznym czerwonym selenem, najbardziej znanym wolnym dla tego elementu. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Berzelius nazwał nowy element Selenium, oparty na imieniu „Selene”, co oznacza „Bogini Księżyca”. Selen jest niezbędnym śladem dla roślin i zwierząt, chociaż w wysokich stężeniach jest to toksyczny element.
Selen ma trzy główne formy alotropowe: czerwony, czarny i szary. Ta ostatnia ma właściwość modyfikowania jego przewodności elektrycznej na podstawie intensywności światła, które go promieniuje (fotokonductor), więc miał wiele zastosowań.
Selen jest szeroko rozpowszechniany w skorupie Ziemi, jednak minerały, które ją zawierają.
Jest to głównie uzyskiwane jako wtórny produkt procesu rafinacji przez elektrolizę miedzi. Selen gromadzi się w szlamie, który znajduje się w anodzie komórek elektrolizy.
Ludzie mają około 25 seleenoprotein, z których niektóre spełniają działanie przeciwutleniające i kontrolują generowanie wolnych rodników. Istnieją również aminokwasy selenu, takie jak selenomekcja i selenocysteina.
[TOC]
Historia
Pierwsza obserwacja
Alchemik Arnold z Villanova mógł zaobserwować selen w 1230. Zostało to utworzone w medycynie w Sorbonie w Paryżu i był nawet doktorem papieża Clemente V.
Villanova w swojej książce Rosarium Philosophorum Opisz czerwoną siarkę lub „siarkę”, która pozostała w piekarniku po odparowaniu siarki. Ta czerwona siarka mogła być wolnym selenem.
Odkrycie
W 1817 r. Jöhs Jakob Berzelius i John Gottlieb Gahn odkryli selen w roślinie chemicznej do produkcji kwasu siarkowego, w pobliżu Gripsholm, Szwecja. Surowcem do opracowania kwasu był piryt, który wyekstrahował z kopalni Falun.
Berzelius został uderzony istnieniem czerwonej pozostałości, która pozostała w pojemniku ołowiowym po spaleniu siarki.
Ponadto Berzelius i Gahn zauważyli, że czerwona pozostałość miała silny zapach pikantnego rzodkiewki, podobny do tego, jak telurio. Powód, dla którego napisał do swojego przyjaciela Marect, że wierzyli, że obserwowany depozyt był związkiem telurio.
Jednak Blelius nadal analizował osadzony materiał, spalinując pirytu i ponownie rozważył, że telurio nie znaleziono w Falun. Podsumował w lutym 1818 roku, że odkrył nowy element.
Pochodzenie twojego imienia
Berzelius wskazał, że nowy element był połączeniem siarki i telurio, a podobieństwo telurio z nowym elementem dało mu możliwość nazwania nowej substancji selenu.
Berzelius wyjaśnił, że „kieliszek” oznacza boginię ziemi. Martin Klaport w 1799 r. To musiało być zrobione!".
Ze względu na podobieństwo telurio z nową substancją, Berzelius nazwał go słowem selenium, pochodzącym z greckiego słowa „selene”, co oznacza „Boginię Księżyca”.
Opracowanie twoich aplikacji
W 1873 roku Willoughby Smith odkrył, że przewodność elektryczna przedstawiona przez selen zależała od światła, które go promieniowało. Ta właściwość pozwoliła seleniowi mieć wiele aplikacji.
Alexander Graham Bell w 1979 roku użył selenu w swoim fotofonie. Selen wytwarza prąd elektryczny proporcjonalny do intensywności światła, które go oświetla, używając światła, mechanizmy bezpieczeństwa do otwierania i zamykania drzwi itp.
Zastosowanie prostowników selenu w elektronice rozpoczęło się od lat 30. XX wieku, z licznymi zastosowaniami komercyjnymi. W latach siedemdziesiątych został wyparta w prostownikach na krzemion.
W 1957 roku odkryto, że selen był niezbędnym elementem życia ssaków, ponieważ był obecny w enzymach, które chronią przed reaktywnym tlenem i wolnymi rodnikami. Ponadto odkryto istnienie aminokwasów, takich jak selenometyna.
Fizyczne i chemiczne właściwości
Wygląd
Istnieje kilka alotropów dla selenu, ich wygląd fizyczny jest różny. Zwykle przedstawia go jako czerwonawo.
Standardowa masa atomowa
78 971 u
Liczba atomowa (z)
3. 4
Temperatura topnienia
221 ° C
Punkt wrzenia
685 ° C
Gęstość
Gęstość selenu różni się w zależności od tego, który rozważany jest alotropowy lub polimorf. Niektóre z jego określonych gęstości w temperaturze pokojowej to:
Gray: 4819 g/cm3
Alfa: 4,39 g/cm3
Szkliste: 4,28 g/cm3
Stan cieczy (punkt topnienia): 3,99 g/cm3
Fusion Heat
Gray: 6,69 kJ/mol
Ciepło parowe
95,48 kJ/mol
Pojemność kaloryczna trzonowa
25 363 J/(mol · k)
Liczby utleniania
Selen można połączyć w swoich związkach, mając następujące liczby lub stany utleniania: -2, -1, +1, +2, +3, +4, +5, +6. Wśród nich najważniejsze to -2 (2-), +4 (wiem4+) i +6 (wiem6+).
Może ci służyć: prosty mikroskopNa przykład w SEO2 Selen ma numer utleniania +4; to znaczy zakłada się istnienie kationu4+ (ON4+ALBO22-). Podobne do SEO3 Selen ma numer utleniania +6 (i6+ALBO32-).
W wodorze seleniuro, h2SE, selen ma liczbę utleniania -2; to znaczy, że ponownie zakłada się istnienie jonu lub anionu2- (H2+ON2-). Wynika to z faktu, że selen jest bardziej elektroongeneracyjny niż wodór.
Elektronialiczność
2.55 na skali Pauling.
Energia jonizacji
-Po pierwsze: 941 kJ/mol.
-Po drugie: 2.045 kJ/mol.
-Po trzecie: 2.973,7 kJ/mol.
Zakon magnetyczny
Diamagnetyczny.
Twardość
2.0 w skali MOHS.
Izotopy
Istnieje pięć naturalnych i stabilnych izotopów selenu, które pokazano poniżej z ich odpowiednimi obfitościami:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Alotropia
 Czarna butelka pokryta cienką warstwą selenu szarości. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Czarna butelka pokryta cienką warstwą selenu szarości. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Selen przygotowany w reakcjach chemicznych to ceglany czerwony amorficzny proszek, który po założeniu szklistego czarnego kształtu, podobny do relacji Rosario (obraz doskonały). Czarny selen to krucha i błyszcząca stała.
Ponadto czarny selen jest lekko rozpuszczalny w siarczku węgla. Gdy ten roztwór jest podgrzewany w temperaturze 180 ° C, szary selen wytrąca.
Grey Selenium jest odporny na utlenianie i jest obojętne od działania nieutleniających kwasów. Główną właściwością tego selenu jest jego fotokonduktywność. Illuminowane zwiększa przewodność elektryczną o współczynnik 10 do 15 razy.
Reaktywność
Selen w swoich związkach istnieje w stanach utleniania -2, +4 i +6. Przejawia wyraźną tendencję do tworzenia kwasów w wyższych stanach utleniania. Związki, które mają selen ze stanem utleniania -2, nazywane są seleniurami (2-).
Reakcja wodoru
Selen reaguje z wodorem z utworzeniem wodoru seleniuro (h2SE), bezbarwny, łatwopalny i śmierdzący gaz.
Reakcja tlenu
Selen pali się, emitując niebieski płomień i tworząc dwutlenek selenu:
ON8 (s) + 8 o2 => 8 SEO2 (S)
Tlenek selenu jest polimerem, białą i stałą substancją. Jego nawodnienie wytwarza kwas selenowy (h2Seo3). Selen tworzy również trójtlenek selenu (SEO3), Analogiczny do siarki (więc3).
Reakcja z halogenami
Selen reaguje z fluorkiem, tworząc selenium hexafluoruro:
ON8 (s) +24 f2 (g) => 8 SEF6 (L)
Selen reaguje z chlorem i bromem, tworząc odpowiednio dichlorek i dyszilenową dibromurę:
ON8 (s) +4 Cl2 => 4 SE2Cl2
ON8 (s) +4 Br2 => 4 SE2Br2
Selen może również tworzyć SEF4 i secl4.
Z drugiej strony selen tworzy związki, w których atom selenu dołącza do jednego z halogenów, a drugi z tlenu. Ważnym przykładem jest tlenklorek seleniowy (SEO2Cl2), Z selenem w utlenianiu +6, niezwykle potężnym rozpuszczalnikiem.
Reakcja z metali
Selen reaguje z metali z tworzeniem glinu, kadmu i seleniurów sodowych. Chemikalia poniżej odpowiada tworzeniu się aluminium seleniuro:
3 SE8 + 16 al => 8 do2ON3
Selenitas
Selenium tworzy sole zwane selenitami; Na przykład: srebrny selenit (ag2Seo3) i selenit sodu (na2Seo3). Ta nazwa została użyta w kontekście literackim w odniesieniu do mieszkańców Księżyca: selenitas.
Kwasy
Najważniejszym kwasem selenowym jest kwas uszczelniający (h2Seo4). Jest tak silny jak kwas siarkowy i łatwiej jest zmniejszyć.
Struktura elektroniczna i konfiguracja
- Selen i jego linki
Selen ma sześć elektronów walencji, dlatego znajduje się ona w grupie 16, taka sama jak tlen i siarka. Te sześć elektronów znajduje się w orbitalach 4 i 4p, zgodnie z ich konfiguracją elektroniczną:
[AR] 3D10 4s2 4p4
Dlatego, podobnie jak siarka, tworzą dwa kowalencyjne wiązania w celu uzupełnienia oktetu walencji; Chociaż ma dostępność swoich orbitali 4D do łączenia więcej niż dwóch atomów. Zatem zbliżają się trzy atomy selenu i tworzą dwa wiązania kowalencyjne: se-se-se.
Selen o większej masie atomowej ma naturalną tendencję do tworzenia struktur rządzonych przez kowalencyjne wiązania; zamiast być ułożonym jako cząsteczki dwuatomiczne2, Se = se, analogiczny do o2, O = O.
- Pierścienie lub łańcuchy
Wśród struktur molekularnych przyjętych przez atomy selenu, dwa można wymienić ogólnie: pierścienie lub łańcuchy. Zauważ, że w hipotetycznym przypadku SE3, Atomy są nadal wymagane do końca; Dlatego muszą powiązać się z innymi atomami, sukcesywnie, aż łańcuch będzie zamknięty na pierścieniu.
Najczęstsze pierścienie to ośmiu członków lub atomy selenu:8 (Korona selenitu). Dlaczego osiem? Ponieważ im mniejszy pierścień, tym większe będzie ucierpieć napięcie; To znaczy, kąty ich linków odbiegają od wartości naturalnych ustawionych przez ich hybrydyzacje SP3 (Podobnie jak w przypadku Cycloalcanos).
Może ci służyć: strzykawka PascalIstnieje osiem atomów, oddzielenie SE-atomów wystarczy, aby ich linki były „zrelaksowane”, a nie „złożone”; Chociaż kąt jego linków wynosi 105,7, a nie 109,5. Z drugiej strony mogą być mniejsze pierścienie: i6 I7.
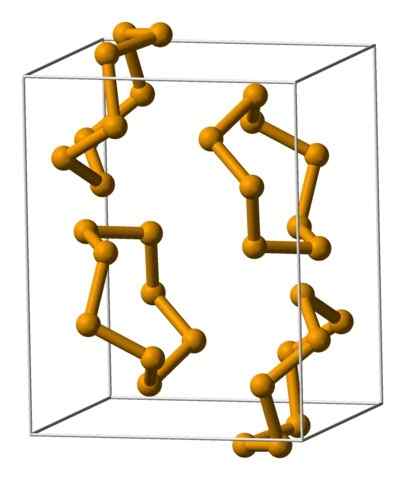 Selen Analeres Jednostki reprezentowane za pomocą modelu sfery i słupków. Źródło: Benjah-BMM27 [domena publiczna].
Selen Analeres Jednostki reprezentowane za pomocą modelu sfery i słupków. Źródło: Benjah-BMM27 [domena publiczna]. Na górnym obrazie pokazano jednostki Analeres8. Zwróć uwagę na podobieństwo do koron siarki; Tylko one są większe i ciężkie.
Oprócz pierścieni atomy selenu mogą być również ułożone w helikalne łańcuchy (pomyśl o schodach ślimakowych):
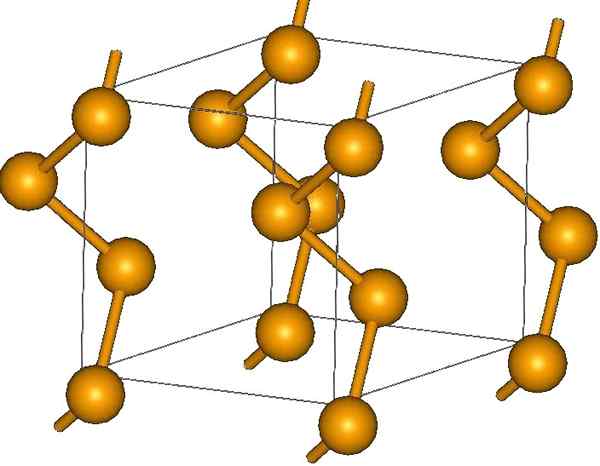 Helikalne łańcuchy selenu. Źródło: MaterialScientist w angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Helikalne łańcuchy selenu. Źródło: MaterialScientist w angielskiej Wikipedii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Na jego końcach mogą znajdować się podwójne łącza terminalowe (-se = se) lub pierścienie są8.
- Alotropy
Biorąc pod uwagę, że mogą istnieć selenowe pierścienie lub łańcuchy, a ich wymiary mogą się również różnić w zależności od liczby zawartych w nich atomów, jest oczywiste, że istnieje więcej niż jeden alotropowy dla tego elementu; To czysty selenium stałe, ale z różnymi strukturami molekularnymi.
Czerwony selen
Wśród najbardziej widocznych szczelgów selenu mamy czerwony, który można przedstawić jako amorficzny pył lub jako kryształy monokliniczne i polimorficzne (patrz obraz pierścieni są8).
W amorficznym czerwonym seleniu struktury są nieuporządkowane, bez widocznych wzorców; Podczas pobytu w obiekcie pierścienie ustanawiają strukturę monokliniczną. Krystaliczny czerwony selen jest polimorficzny, ma trzy fazy: α, β i γ, które różnią się pod względem gęstości.
Czarny selen
Struktura czarnego selenu składa się również z pierścieni; Ale nie ośmiu członków, ale wielu innych, do pierścienia tysiąca atomów (1000). Mówi się następnie, że jego struktura jest złożona i składa się z pierścieni polimerowych; niektóre większe lub małe niż inne.
Gdy istnieją pierścienie polimeryczne o różnych rozmiarach, trudno jest poczekać na ustanowienie kolejności strukturalnej; Zatem czarny selen jest również amorficzny, ale w przeciwieństwie do czerwonawego pyłu wspomnianego powyżej, ma szkliste kontekstry, chociaż jest kruche.
Grey Selen
I wreszcie, najprostsze szczeliny selenu jest szary, który wyróżnia się ponad innymi, będąc najbardziej stabilnym w normalnych warunkach, a także o metalicznym wyglądzie.
Ich kryształy mogą być sześciokątne lub trygonalne, ustanowione przez londyńskie siły dyspersji między ich polimerowymi łańcuchami spiralnymi (obraz doskonały). Kąt jego połączeń wynosi 130,1 °, co wskazuje na dodatnie odchylenie środowisk czworościennych (o kątach 109,5 °).
Właśnie dlatego selen helikalne łańcuchy sprawiają, że są „otwarte”. W ramach wyjaśnienia w tej strukturze atomy są konfrontowane, więc teoretycznie musi istnieć większe nakładanie się ich orbitali, aby stworzyć pasma napędowe.
Ciepło ze wzrostem wibracji molekularnych szkodzi tym pasmom, gdy łańcuchy są nieuporządkowane; Podczas gdy energia fotonu wpływa bezpośrednio na elektrony, ekscytują je i promuje ich transakcje. Z tej wizji „łatwo” wyobrazić sobie fotokonduktywność dla selenu szarości.
Gdzie jest i produkcja
Chociaż jest szeroko rozpowszechniony, selen jest rzadkim elementem. Jest w stanie rodzimym związanym z siarką i minerałami, takimi jak Eucuairita (Cuagse), Cloustalita (PBSE), naumanite (Ag Ag2SE) i Crookesite [(Cutiag)2ON].
Selen występuje jako zanieczyszczenie, które zastępuje siarkę w niewielkiej części metalowej siarki minerały; takie jak miedź, ołów, srebro itp.
Istnieją gleby, w których selen istnieje w rozpuszczalnej formie selenianu. Są one przenoszone przez wody deszczów do rzek, a stamtąd w kierunku oceanu.
Niektóre rośliny są w stanie wchłonąć i skoncentrować selen. Na przykład kubek orzechów w Brazylii zawiera 544 µg selenu, co oznacza 777% ilości selenu zalecanego dziennie.
W żywych istotach selen występuje w niektórych aminokwasach, takich jak: selenomentaina, selenocysteina i metylolenocysteina. Selenocysteina i selenit są redukowane do seleniuro wodoru.
Elektroliza miedzi
Nie ma eksploatacji selenu wydobywczego. W większości jest uzyskiwane jako wtórny produkt procesu rafinacji przez elektrolizę miedzi, będąc w mułu, który gromadzi się w anodzie.
Pierwszy krok obejmuje produkcję dwutlenku selenu. W tym celu leczy się anodowy szczupły z węglanem sodu w celu wytworzenia jego utleniania. Następnie dodaje się tlenek selenu i jest zakwaszony, tworząc kwas selenowy.
Wreszcie, jest to kwas selenowy z dwutlenkiem siarki do wytworzenia jego redukcji i uzyskania elementarnego selenu.
W innej metodzie w mieszaninie mułu i błota utworzonego w wytwarzaniu kwasu siarkowego uzyskuje się nieczystego selenu czerwonego.
Następnie powstają kwas selenarny i kwas sprzedawczy. Ten wiążący kwas otrzymuje takie samo leczenie, co poprzednia metoda.
Można również zastosować chlor, który działa na metalowe seleniuros do wytwarzania lotnych związków chlorowanych selenium; takie jak: Wiem2Cl2, Secl4, Secl2 i Seocl2.
Może ci służyć: poziom chemicznyZwiązki te, w procesie przeprowadzonym w wodzie, stają się kwasem selenowym, który jest traktowany dwutlenkiem siarki w celu uwolnienia selenu.
Artykuł biologiczny
Niedobór
Selen jest niezbędnym śladem dla roślin i zwierząt, których niedobór u ludzi spowodował poważne zaburzenia, takie jak choroba Keshana; Choroba charakteryzująca się uszkodzeniem mięśnia sercowego.
Ponadto niedobór selenu jest związany z niepłodnością mężczyzn i może odgrywać rolę w chorobie Kashina-Becka, rodzajem choroby zwyrodnieniowej stawów. Podobnie, niedobór selenu zaobserwowano w reumatoidalnym zapaleniu stawów.
Enzymatyczny kofaktor
Selen jest składnikiem enzymów o działaniu przeciwutleniają.
Ponadto selen jest kofaktorem deiodinaz hormonów tarczycy. Te enzymy są ważne w regulacji funkcjonowania hormonów tarczycy.
Zastosowanie selenu zostało wskazane w leczeniu choroby Hasimoto, choroby autoimmunologicznej z tworzeniem się przeciwciał przeciwko komórkom tarczycy.
Selenium zastosowano również w celu zmniejszenia toksycznych działań rtęci, ponieważ niektóre z jego działań są wywierane na enzymy przeciwutleniające zależne od selenu.
Białka i aminokwasy
Mężczyzna ma około 25 seleenoprotein, które wywierają działanie przeciwutleniające na ochronę przed stresem oksydacyjnym, zainicjowane przez nadmiar reaktywnych form tlenu (ROS) i reaktywnych gatunków azotu (Ni).
Wykryto obecność aminokwasów selenometheocyny i selenocysteiny u ludzi. Selenomekcja jest stosowana jako suplement diety w leczeniu stanów niedoboru selenu.
Ryzyko
Wysokie stężenie ciała selenu może mieć liczne szkodliwe działanie na zdrowie, zaczynając od kruche włosy i kruche paznokcie, na wysypki skórne, ciepło, obrzęk skóry i silny ból.
W kontakcie z oczami w kontakcie z oczami ludzie mogą wyrażać zapał, podrażnienie i łzę. Tymczasem przedłużone narażenie na dym z wysoką zawartością selenu może powodować obrzęk płuc, oddech czosnkowy i zapalenie oskrzeli.
Ponadto osoba może doświadczyć zapalenia pneumsonów, nudności, dreszcze, gorączki, bólu gardła, biegunki i wątroby.
Selen może oddziaływać z innymi lekami i suplementami diety, takimi jak leki przeciwcyszczowe, leki przeciwnowotworowe, kortykosteroidy, niacyna i pigułki do kontroli urodzeń.
Selen wiąże się ze zwiększonym ryzykiem zarażenia się na raka skóry. W badaniu przeprowadzonym przez National Cancer Institute wskazano, że mężczyźni z wysokim stężeniem ciała selenu mieli dwukrotnie prawdopodobieństwo, że cierpieć na agresywny rak prostaty.
Badanie wskazuje, że dzienne spożycie 200 µg selenu wzrasta o 50% możliwość opracowania cukrzycy typu II.
Aplikacje
Kosmetyki
Siarczek selenu stosuje się w leczeniu łożyska, a także tłustego lub łupieżu.
Lekarze
Jest stosowany jako medycyna alternatywna w leczeniu choroby Hasimoto, autoimmunologicznej choroby tarczycy.
Selen zmniejsza toksyczność rtęci, której jedna z jego toksycznych aktywności wywiera się na enzymy deoksydowe, które wykorzystują selen jako kofaktor.
Elektroliza manganu
Zastosowanie tlenku selenu w elektrolizy manganu znacznie zmniejsza koszty techniki, ponieważ zużycie elektryczne zmniejsza się.
Pigment
Selen jest stosowany jako pigment w obrazach, tworzywa sztucznym, ceramice i szkła. W zależności od selenu użyty kolor szklanki zmienia się od głębokiego czerwieni do jasnopomarańcz.
Fotoprzewodowy
Ze względu na właściwość szarego selenu zmiany jego przewodnictwa elektrycznego w zależności od intensywności światła, które go promieniuje, selen został użyty w kserokopiach, fotocyperach, fotometrach i ogniwach słonecznych.
Zastosowanie selenu w kserokopiach było jednym z głównych zastosowań selenu; Ale pojawienie się organicznych fotokonductorów zmniejsza jego użycie.
Kryształy
Selen jest używany do przebarwienia szkła, w wyniku obecności żelaza, które wytwarza zielone lub żółte zabarwienie. Ponadto pozwala na czerwone zabarwienie szkła, w zależności od zastosowania, które chcesz podać.
Wulkanizacja
Dietenio dietenium jest stosowane jako środek wulkanizujący produktów gumowych.
Stopy
Selen jest stosowany w połączeniu z bizmutem w mosiądzu, aby zastąpić ołów; Bardzo toksyczny element, który zmniejszył jego wykorzystanie z powodu zaleceń agencji zdrowia.
Selen jest dodawany do niskich stężeń do stopów stali i miedzi w celu poprawy łatwości korzystania z tych metali.
Prostownicy
Prostownicy selenu zaczęły być używane w 1933 r. Do 70. XX wieku, kiedy zastąpiono je krzem o niskiej jakości i wyższej jakości.
Bibliografia
- Royal Australian Chemical Institute. (2011). Selen. [PDF]. Odzyskane z: Raci.org.Au
- Wikipedia. (2019). Selen. Źródło: w:.Wikipedia.org
- Sato Kentaro. (S.F.). Nowe alotropy głównych elementów grupowych. [PDF]. Źródło: tcichemicals.com
- Dr. Ciasto Stewart. (2019). Fakty elementów selenu. Chemicool. Odzyskane z: Chemicool.com
- Robert c. Brazy. (28 sierpnia 2019). Selen. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Marques Miguel. (S.F.). Selen. Odzyskane z: Nautilus.Fis.UC.Pt
- Helmestine, Anne Marie, pH.D. (3 lipca 2019). Fakty selenu. Odzyskane z: Thoughtco.com
- Lentech b. V. (2019). Tabela okresu: selen. Odzyskane z: lentech.com
- Tinggi u. (2008). Selen: jego rola jako przeciwutleniacza w zdrowiu ludzkim. Zdrowie środowiskowe i zapobiegaj medycynie, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Biuro suplementów diety. (9 lipca 2019 r.). Selen: arkusz faktów dla pracowników służby zdrowia. National Institute of Health. Źródło: SDG.Od.Nih.Gov

