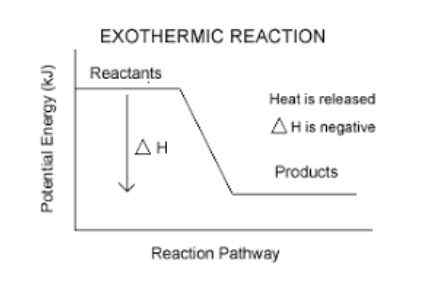
Reakcja egzotermiczna
- 1735
- 317
- Arkady Sawicki
Wyjaśniamy, jakie reakcje egzotermiczne, ich cechy, różnice w reakcjach endotermicznych są i podajemy kilka przykładów
Jakie są reakcje egzotermiczne?
reakcje egzotermiczne Są to reakcje chemiczne, które uwalniają energię w postaci ciepła. Słowo egzotermiczne jest tworzone przez "Exo" co oznacza „wyjście” i "termos" co oznacza ciepło, więc „reakcja egzotermiczna” dosłownie oznacza reakcję, w której wychodzi ciepło.
Te reakcje są bardzo powszechne i możemy je znaleźć wszędzie, od naszych domów po komórki, które są częścią naszego ciała.
W domu możemy je znaleźć w kuchni, gdy gaz pali się w rogu, aby ugotować nasze jedzenie. Znajdujemy je również w silnikach samochodowych, gdy spalają paliwo.
 Przykład reakcji egzotermicznej
Przykład reakcji egzotermicznej Z drugiej strony reakcje egzotermiczne są niezbędne do życia, ponieważ zapewniają komórkom energię, której potrzebują do życia, rozwoju i rozmnażania.
Charakterystyka reakcji egzotermicznych
Uwalniają energię w postaci ciepła
Jest to główna cecha, która czyni je egzotermicznymi reakcjami.
Uwolniona energia pochodzi z tych samych odczynników
Każda reakcja chemiczna wymaga pewnej energii aktywacji. W przypadku reakcji egzotermicznych energia ta pochodzi z tych samych odczynników po przekształceniu w produkty.
Produkty reakcji egzotermicznych są zawsze bardziej stabilne niż odczynniki.
Odczynniki, stając się produktami, tracą część swojej energii w postaci ciepła. Z tego powodu produkty zawsze pozostają z mniejszą energią niż odczynniki, co czyni je bardziej stabilnymi.
Mają negatywną zmianę entalpii.
Jest to łatwy sposób, aby wiedzieć, czy reakcja jest egzotermiczna, czy nie. Każda reakcja, która ma negatywne AH (odczyt delta h), będzie egzotermiczna.
- Na przykład, Reakcja spalania butanu (gaz, który spalamy w kuchni) ma odmianę entalpii -11.823 kcal/mol. Dlatego jest to reakcja egzotermiczna.
W większości przypadków potrzebują tylko spustu.
Wiele reakcji egzotermicznych potrzebuje tylko czegoś, co daje im wystarczającą energię, aby zacząć. Po tym to samo ciepło, które uwalniają, wystarcza, aby zachować reakcję.
- Na przykład, Przez spalanie gazu potrzebna jest tylko jedna iskra, wówczas płomień nadal włącza się, aż gaz się skończy.
Różnice między reakcjami egzotermicznymi a reakcjami endotermicznymi
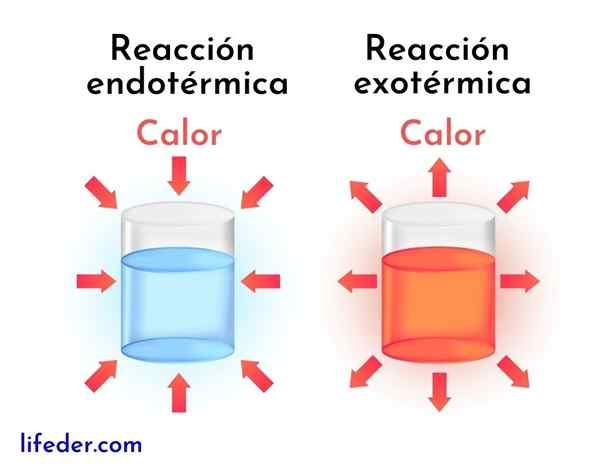
Reakcje egzotermiczne są przeciwieństwem reakcji endotermicznych. W tym ostatnim odczynniki pochłaniają energię w postaci ciepła zamiast jej uwalniania, jak w reakcjach egzotermicznych.
Następnie przedstawiono główne różnice między reakcjami egzotermicznymi i endotermicznymi:
Reakcje egzotermiczne | Reakcje endotermiczne |
Uwalniają energię w postaci ciepła. | Absorbują energię w postaci ciepła. |
Mają negatywną zmienność entalpii, to znaczy DH<0. | Mają pozytywną zmianę entalpii, czyli Dh> 0. |
Mają tendencję do zwiększania temperatury otaczającej. | Mają tendencję do zmniejszania temperatury lub ostygnięcia. |
Energia, która utrzymuje chodzenie reakcji, pochodzi z tych samych odczynników. | Energia, która utrzymuje reakcję, pochodzi z otoczenia. |
Bardziej stabilne produkty są zawsze uzyskiwane z mniejszą energią. | Mniej stabilne produkty są zawsze uzyskiwane z wyższym poziomem energii. |
Przykłady egzotermicznych reakcji
Spalanie gazu kuchennego
W większości domów na świecie gazem używanym do gotowania jedzenia jest butan, który ma wzór molekularny C4H10. Ten węglowodór jest spalany tlenem powietrza za pomocą następnej reakcji spalania uwalniającej duże ilości ciepła:
Może ci służyć: prosty mikroskop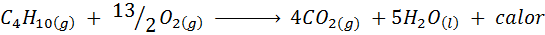
Eksplozja dynamitu
Dynamit zawiera wybuch zwany nitrogliceryną (C3H5N3ALBO9). Ten związek rozkłada się bardzo gwałtownie uwalniając duże ilości ciepła, co powoduje wielką eksplozję. Reakcja chemiczna to:
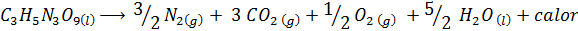
Ta reakcja ma ΔH = -368 kcal⁄mol, Jest to więc reakcja egzotermiczna.
Spontaniczne spalanie białego fosforu
Element fosforu (P) można znaleźć jako czerwony fosfor lub biały fosfor. Biały fosfor. Reakcja to:
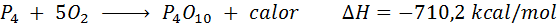
Oddychanie komórkowe
Oddychanie komórkowe jest egzotermiczną reakcją chemiczną, która polega na utlenianiu żywności, którą jemy. Ciepło uwalniane przez tę reakcję jest wykorzystywane przez komórki do wykonywania niekończących się endotermicznych reakcji chemicznych, które wymagają energii.
Fajerwerki
Fajerwerki zawierają czarny strzelnica jako główny komponent wybuchowy. Księstwo prochowe to mieszanina zawierająca azotan potasu, grafit i węgiel siarki, który reaguje ze sobą poprzez reakcję egzotermiczną. Ciepło, które uwalnia ta reakcja, generuje szeroki zakres kolorów, które widzimy w niebie.
Chemiczny podkład termiczny
Podkładki termiczne są używane jako gorące kompresy do złagodzenia kontuzji sportowych. Składają się one z zamkniętej torby zawierającej wodę i chemika wewnątrz małej rurki. Gdy rurka jest zepsuta, chemik jest mieszany z wodą wytwarzającą egzotermiczną reakcję chemiczną, która ogrzewa podkładkę.
Metalowa reakcja sodu z wodą
Sód (Na) jest bardzo reaktywny metal alkaliczny, który w kontakcie z wodą reaguje gwałtownie uwalnianie dużej ilości ciepła i wodoru gazowego. Reakcja to:
Może ci służyć: metody rozdziału heterogenicznych mieszanin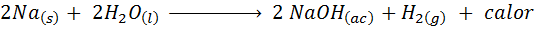
Ta reakcja uwalnia 1900 kalorii dla każdego grama Na, który reaguje z wodą. Oznacza to, że 1 gram sodu wystarczyłby do podgrzewania 3 średniej kawy.
Rozpuszczanie detergentu
Jest to reakcja, której każdy może doświadczyć w swoim domu. Biorąc garść detergentu odkurzającego, aby myć ubrania i zmoczyć je odrobiną wody, ręka natychmiast będzie gorąca. Wynika to z faktu, że proces rozpuszczania detergentu w wodzie jest egzotermiczny.
Reakcja Trimita
Terminta jest mieszaniną aluminium w postaci bardzo drobnego proszku i tlenku innego metalu, takiego jak żelazo. Po iskry, która ma miejsce, jest:
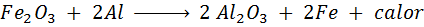
Ta reakcja uwalnia tyle ciepła, które jest zdolne do topienia żelaza i jest używane do spawania pociągów pociągów.
Kondensacja wody
Dla wszystkich substancji zmiany fazy gazowej (kondensacja), ciecz na ciało stałe (zestalenie się) i gaz stały (osadzanie), zawsze uwalniają ciepło, a zatem są procesami egzotermicznymi. W przypadku wody kondensacja zaledwie 18 gramów wody uwalnia około 10.000 kalorii, które wystarczy, aby podgrzać 15 małych filiżanek kawy.
Bibliografia
- Chang, R. i Goldsby, K. (2014). Chemia. 11 wyd. Nowy Jork: McGraw-Hill Education.
- Reakcja egzotermiczna (2020, 19 grudnia). W Wikipedii. Pochodzi z.Wikipedia.org
- Holmes, w. S. (1963). Ciepło spalania fosforu i entalpie tworzenia p4o10 i h3po4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada p. od., F. Siema. (2014). Petardy, rakiety i dużo chemii. Edukacja chemiczna. 44-51. Doi: 10.2436/20.2003.02.134
- Reakcja termitowa. University of Minnesota (Wydział Chemii). Pobrane z chemii.Umn.Edu

