Jaka jest anoda i katoda?

- 1097
- 121
- Pani Gilbert Stolarczyk
On Anoda i katoda Są to rodzaje elektrod znalezionych w komórkach elektrochemicznych. Są to urządzenia zdolne do wytwarzania energii elektrycznej poprzez reakcję chemiczną. Najczęściej używane komórki elektrochemiczne to baterie.
Istnieją dwa rodzaje komórek elektrochemicznych, komórki elektrolityczne i komórki galwaniczne lub woltowe. W komórkach elektrolitycznych reakcja chemiczna wytwarzana przez energię nie ma miejsce spontanicznie, ale prąd elektryczny przekształca się w reakcję utleniania chemicznego.

Komórka galwaniczna składa się z dwóch pół -lodgów. Są one połączone dwoma elementami, metalowym kierowcą i mostem soli fizjologicznej.
Przewód elektryczny, jak wskazuje jego imię, prowadzi energię elektryczną, ponieważ ma bardzo niewielki opór na ruch ładunku elektrycznego. Najlepsze sterowniki to zwykle metale.
Mostka soli fizjologicznej to rurka, która łączy dwa półprzestrzeni, przy jednoczesnym utrzymaniu kontaktu elektrycznego i bez pozwolenia, aby komponenty każdego ogniwa łączą się.Każde półmedia ogniwa galwanicznego zawiera elektrodę i elektrolit.
Gdy zachodzi reakcja chemiczna, jeden z półfiladów traci elektrony z elektrodą, poprzez proces utleniania; podczas gdy drugi wygrywa elektrony do elektrody, poprzez proces redukcji.
Procesy utleniania są wytwarzane w anodzie, a procesy redukcji w katodzie
[TOC]
Anoda
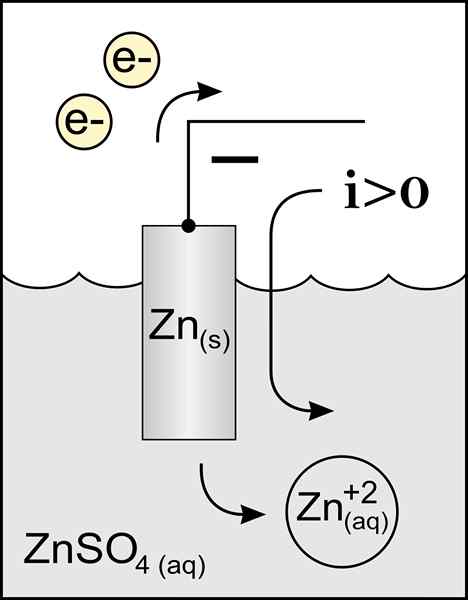 Diagram anody cynku w komórce woltowo -. Źródło: Original Praca: Plik: CYNC ANODE 2.PNG przez użytkownika: Micheljullian (dyskusja) Praca pochodna: KES47/CC BY-S (http: // creativeCommons.Org/licencje/by-sa/3.0/)
Diagram anody cynku w komórce woltowo -. Źródło: Original Praca: Plik: CYNC ANODE 2.PNG przez użytkownika: Micheljullian (dyskusja) Praca pochodna: KES47/CC BY-S (http: // creativeCommons.Org/licencje/by-sa/3.0/) Nazwa anody pochodzi od greckiego ανά (Aná): Up i οδός (Odós): ścieżka. Faraday był tym, który wymyślił ten termin w XIX wieku.
Najlepszą anodą definiującą jest elektroda, która traci elektrony w reakcji utleniania. Zwykle jest powiązany z dodatnim biegunem tranzytu prądu elektrycznego, ale nie zawsze tak jest.
Może ci służyć: cenne rozwiązaniaChociaż w akumulatorach anoda jest słupem dodatnim, w światłach LED jest odwrotnie, anodą jest biegun.
Zwykle zdefiniowane jest poczucie prądu elektrycznego, doceniając go jako poczucie swobodnych obciążeń, ale jeśli kierowca nie jest metaliczny, wytworzone opłaty dodatnie są przenoszone do zewnętrznego sterownika.
Ruch ten sugeruje, że mamy ładunki dodatnie i ujemne, które poruszają się w przeciwnych zmysłach, więc mówi się, że kierunek prądu jest drogą dodatnich ładunków kationów, które znajdują się w anodzie w kierunku obciążenia ujemnego anodów Anody znajdujące się w katodzie.
W komórkach galwanicznych, mając metalowy przewód, prąd wygenerowany w reakcji podąża ścieżką z bieguna dodatniego do ujemnego.
Ale w komórkach elektrolitycznych nie ma metalowego przewodu, ale można znaleźć elektrolit, jony o dodatnim i ujemnym obciążeniu, które poruszają się w przeciwnych zmysłach.
Anody termojonowe otrzymują większość elektronów pochodzących z katody, podgrzewaj anodę i muszą znaleźć sposób na rozproszenie. Ciepło to jest generowane w napięciu występującym między elektronami.
Specjalne anody
Istnieje rodzaj specjalnych anod, takich jak te w ramach x -. W tych probówkach energia wytwarzana przez elektrony, oprócz wytwarzania x.
To ciepło występuje z różnym napięciem między obiema elektrodami i które wywiera ciśnienie na elektrony. Kiedy elektrony poruszają się w prądu elektrycznym, uderzają w anodę, przesyłając ciepło.
Może ci służyć: Henderson-Haselbalch Równanie: wyjaśnienie, przykłady, ćwiczeniaKatoda
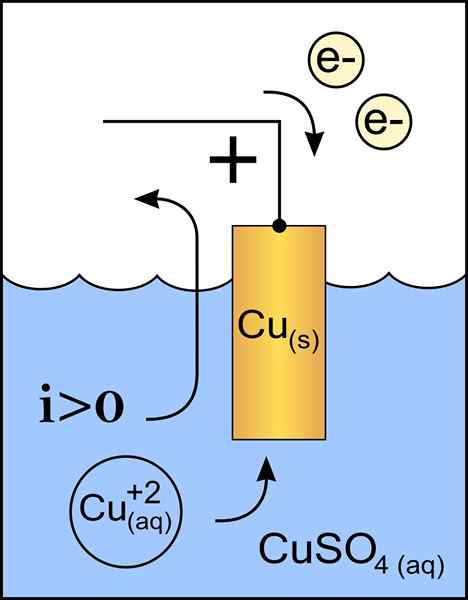 Schemat katody miedzianej w komórce woltejskiej. Źródło: Original Praca: Plik: CYNC ANODE 2.PNG przez użytkownika: Micheljullian (dyskusja) Praca pochodna: KES47/CC BY-S (http: // creativeCommons.Org/licencje/by-sa/3.0/)
Schemat katody miedzianej w komórce woltejskiej. Źródło: Original Praca: Plik: CYNC ANODE 2.PNG przez użytkownika: Micheljullian (dyskusja) Praca pochodna: KES47/CC BY-S (http: // creativeCommons.Org/licencje/by-sa/3.0/) Katoda jest elektrodą o obciążeniu ujemnym, która w reakcji chemicznej cierpi reakcja redukcji, w której jej stan utleniania jest zmniejszony, gdy odbiera elektrony.
Podobnie jak w przypadku anody, to Faraday zasugerował termin katoda, która pochodzi od greckiego κατά [catá]: „Down” i ὁδός [odós]: „droga”. Do tej elektrody obciążenie ujemne zostało przypisane w czasie.
Takie podejście było fałszywe, ponieważ w zależności od urządzenia, w którym się znajduje, ma ładunek lub inny.
Ten związek z biegunem ujemnym, podobnie jak w przypadku anody, wynika z założenia, że prąd przepływa z bieguna dodatni do ujemnego. To powstaje w komórce galwanicznej.
W komórkach elektrolitycznych środki przenoszenia energii, ponieważ nie jest ona w metalu, ale w elektrolicie, może współistnieć jony ujemne i dodatnie, które poruszają się w przeciwnych zmysłach. Ale na mocy porozumienia mówi się, że prąd przechodzi od anody do katody.
Specjalne katody
Rodzaj określonych katod to katody termioniczne. W nich katoda emituje elektrony ze względu na efekt ciepła.
W zaworach termionicznych katoda może się ogrzewać, krążył prąd grzewczy w filamencie, który go sprzęga.
Reakcja równowagi
Jeśli weźmiemy komórkę galwaniczną, która jest najczęstszą komórką elektrochemiczną, możemy sformułować generowaną reakcję równowagi.
Każda półmedia, która tworzy komórkę galwaniczną, ma charakterystyczne napięcie znane jako potencjał redukcji. W ramach każdego półproduktu występuje reakcja utleniania między różnymi jonami.
Może ci służyć: spektrum absorpcjiGdy ta reakcja osiągnie równowagę, komórka nie może zapewnić większego napięcia. W tej chwili utlenianie, które ma miejsce w półprodukcie tego momentu, będzie miało wartość dodatnią, im bliżej jest. Potencjał reakcji będzie większy, im większa równowaga jest osiągana.
Kiedy anoda jest w równowadze, zaczyna tracić elektrony przechodzące przez kierowcę do katody.
W katodzie ma miejsce reakcja redukcji, im większa potencjalna równowaga będzie miała reakcję podczas wytwarzania i przyjmowania elektronów pochodzących z anody.
Bibliografia
- Huheey, James i., i in.Chemia nieorganiczna: zasady struktury i reaktywności. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Chemia: zasady i właściwości. Nowy Jork, USA: McGraw-Hill, 1966.
- Brady, James i.Chemia ogólna: zasady i struktura. Wiley, 1990.
- Petrucci, Ralph H., i in.Chemia ogólna. Inter -American Educational Fund, 1977.
- Masterton, William L.; Hurley, Cecile N.Chemia: zasady i reakcje. Cengage Learning, 2015.
- Charlot, Gaston; TreMillon, Bernard; Badoz-Lambling, J. Reakcje elektrochemiczne. Toray-Masson, 1969.
- « 10 najważniejszych wkładów i wynalazków
- Quetzal Charakterystyka, siedlisko, reprodukcja, żywność »

