Białka G Struktura, typy i funkcje
- 1848
- 259
- Paweł Malinowski
G albo Białka wiążące nukleotyd guaniny, Są to białka związane z błoną plazmatyczną należącą do rodziny „łączników” sygnałów, które mają ważne funkcje w wielu procesach transdukcji sygnału w organizmach eukariotycznych.
W literaturze białka G są opisywane jako binarne przełączniki molekularne, ponieważ ich aktywność biologiczna zależy od zmian w ich strukturze podawanej przez gatunki nukleotydowe, do których są zdolne do łączenia: nukleotydy guanozyny (difosforan (PKB) i typosforan (GTP)).
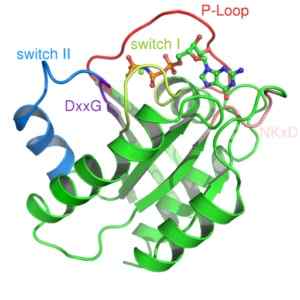
 Struktura białka Ras, monomerycznego białka G (źródło: Mark „Absturrz” [domena publiczna] przez Wikimedia Commons)
Struktura białka Ras, monomerycznego białka G (źródło: Mark „Absturrz” [domena publiczna] przez Wikimedia Commons) Są one na ogół aktywowane przez receptory rodziny białka znane jako receptory sprzężone z GPCR (GPCR, angielski ”Odbiorniki sprzężone z białkiem G ”), który otrzymuje zewnętrzny sygnał początkowy i wprowadza go do zmian konformacyjnych, które wywołują aktywację, co następnie przekłada się na aktywację innego białka efektorowego.
Niektórzy autorzy uważają, że geny kodujące dla tej rodziny białka ewoluowały w powielaniu i rozbieżności przodkowego genu, którego produkt był udoskonalony i specjalizujący się w coraz więcej.
Wśród szerokiej gamy funkcji komórkowych, które mają te białka, jest translokacja makrocząsteczek podczas syntezy białek, transdukcja sygnałów hormonalnych i bodźców czuciowych, a także regulacja proliferacji i różnicowania komórek.
Dwie klasy zostały opisane z tego typu białka: małe białka G i heterotrofimeryczne białka G. Pierwszą trzy wymiarową strukturę białka G uzyskano ponad dekadę z małego białka G znanego jako RAS.
[TOC]
Struktura
Strukturalnie rozpoznawane są dwa typy białek g: małe białka G i heterotrymiczne białka G, znacznie bardziej złożone.
Małe białka G powstają przez pojedynczy polipeptyd około 200 odpadów aminokinacyjnych i około 20-40 kDa, aw jego strukturze występuje zachowana domena katalityczna (domena G) złożona z pięciu śmigieł α, sześciu arkuszy umieszczonych β i pięciu polipeptydów Pętle.
Z drugiej strony heterotrofimeryczne białka G są kompleksowymi białkami błonowymi, które składają się z trzech łańcuchów polipeptydowych, znanych jako podjednostki α, β i γ.
-Podjednostka α waży od 40 do 52 kDa, ma region wiązania nukleotydów guaniny i ma aktywność GTPASA w celu hydrolizowania powiązań między grupami fosforanowymi GTP.
Podjednostki α różnych białek G mają niektóre domeny strukturalne, takie jak związek GTP i hydroliza, ale są bardzo różne w miejscach wiązania receptora i białkach efektorowych.
Może ci służyć: wrzeciona mitotyczne-Podjednostka β ma nieco niższą masę cząsteczkową (między 35 a 36 kDa).
-Z drugiej strony podjednostka γ jest znacznie mniejsza i ma przybliżoną masę cząsteczkową 8 kDa.
Wszystkie heterotrofimeryczne g. Te dwie domeny są tak silnie powiązane, że są rozważane jako pojedyncza jednostka funkcjonalna.
Chłopaki
Jak wspomniano wcześniej, istnieją dwa rodzaje białek G: małe i heterotriméricas.
Małe białka G mają funkcje wzrostu komórek, wydzielanie białka i interakcji pęcherzyków wewnątrzkomórkowych. Ze swojej strony heterotrofimeryczne białka G są związane z transdukcją sygnału z receptorów powierzchniowych, a także działają jako przełączniki, które naprzemiennie między dwoma stanami w zależności od powiązanego nukleotydu.
Małe białka G
Białka te są również nazywane małymi GTPASA, małe białka połączenia GTP lub nadrodzina białka Ras i tworzą niezależną nadrodzinę w dużej klasie hydrolazy GTP z funkcjami regulacyjnymi.
Te białka są bardzo zróżnicowane i kontrolują wiele procesów komórkowych. Charakteryzują się zachowaną domeną wiązania z GTP, domeną „g”. Związek tego fosforanu nukleotydowego powoduje niewielkie zmiany konformacyjne w swojej domenie katalitycznej w białkach GD.
Jego aktywność jest ściśle związana z białkami aktywującymi GTPASA (luka, angielski ”Białko aktywujące GTPazy ”) i z czynnikami wymiany nukleotydów Guanina (GEF, angielski ”Współczynnik wymiany nukleotydów guaniny ”).
W eukariotach opisano pięć klas lub rodzin małych białek G:
-Ras
-Rho
-Rab
-SAR1/ARF
-Biegł
Białka Ras i Rho kontrolują ekspresję genetyczną, a białka Rho również modulują reorganizację cytoszkieletu. Białka grupy RAB i SAR1/ARF mają wpływ na transport pęcherzykowy, a białka regulują transport jądrowy i cykl komórkowy.
Heterotrofimeryczne białka G
Ten typ białka zasługuje również na związek z dwoma innymi czynnikami białkowymi, tak że droga sygnalizacyjna z zewnątrz do wnętrza komórkowego składa się z trzech elementów w następującej kolejności:
- sprzężone receptory Białka g
- G
- Białka albo Skuteczne kanały
Istnieje duża różnorodność heterotrofimerycznego białka G, co jest związane z wielką różnorodnością podjednostek α, które istnieją w naturze, w których zachowuje się tylko 20% sekwencji aminokwasowej.
Zwykle heterotrofimeryczne białka G są identyfikowane dzięki różnorodności podjednostki α, opartej głównie na podobieństwach funkcjonalnych i sekwencji.
Podjednostki α stanowią cztery rodziny (rodzina GS, rodzina GI/O, rodzina GQ i rodzina G12). Każda rodzina składa się z innego „izotypu”, który razem dodaje ponad 15 różnych sposobów podjednostek α.
Rodzina gS
Ta rodzina zawiera przedstawicieli, którzy również uczestniczą w pozytywnej regulacji białek adenylanowych cyklazy i jest wyrażana w większości typów komórek. Składa się z dwóch członków: GS i golfa.
Kloprz ”S " Odnosi się do stymulacji (z angielskiego ”Stymulacja ") i indeks dolny ”Olf " Odnosi się do „zapachu” (z angielskiego „Olfaction”). Białka golfowe są wyrażane szczególnie w neuronach czuciowych odpowiedzialnych za zapach.
Rodzina gI/O
To największa i różnorodna rodzina. Są one wyrażane w wielu typach komórek i pośredniczą w zależnym od odbierania hamowania kilku rodzajów klas adenylosiowych (indeks dołu ”Siema" odnosi się do hamowania).
Białka z podjednostkami grupy α są wyrażane szczególnie w komórkach ośrodkowego układu nerwowego i mają dwa warianty: A i B.
Rodzina gQ
Białka z tą rodziną podjednostki α są odpowiedzialne za regulację fosfolipazy C. Ta rodzina składa się z czterech członków, których podjednostki α są wyrażane przez różne geny. Są obfite w komórkach wątroby, w komórkach nerkowych i płucach.
Rodzina g12
Ta rodzina jest wyrażana wszechobecnie w organizmach i nie jest znane z pewności, jakie dokładnie procesy komórkowe regulowane przez białka z tymi podjednostkami.
Podjednostki β i γ
Chociaż różnorodność struktur alfa decyduje o identyfikacji białek heterotimerycznych, istnieje również duża różnorodność w odniesieniu do pozostałych dwóch podjednostek: beta i gamma.
Funkcje
Białka G uczestniczą w „kierowaniu” sygnałów z receptorów w błonie plazmatycznej do kanałów efektorowych lub enzymów.
Najczęstszym przykładem funkcji tego typu białka jest regulacja enzymatycznej cyklasy adenylanowej, enzymu odpowiedzialnego za syntezę adenozyny 3 ', 5'-monofosforanu lub po prostu cyklicznego wzmacniacza, cząsteczki, która ma ważne funkcje jako Second Schempantenger. W wielu znanych procesach komórkowych:
Może ci służyć: komórki kaliciformowe-Selektywna fosforylacja białka z określonymi funkcjami
-Transkrypcja genetyczna
-Reorganizacja cytoszkieletu
-Wydzielanie
-Depolaryzacja błony
Uczestniczą również pośrednio w regulacji wodospadu sygnalizacyjnego inozytoli (fosfatydyloinitol i ich fosforylowane pochodne), które są odpowiedzialne za kontrolę procesów zależnych od wapnia, takich jak chemiotaksja i wydzielanie czynników rozpuszczalnych.
Wiele kanałów jonowych i białek transportowych jest bezpośrednio kontrolowanych przez białka g białka G. Podobnie białka te są zaangażowane w wiele procesów sensorycznych, takich jak widzenie, zapach, między innymi.
Jak oni pracują?
Tryb interakcji białka G z białkami efektorowymi jest typowy dla każdej klasy lub rodziny białka.
W przypadku białek G receptora G (heterotrofimeryczne białka G), połączenie nukleotydu guaniny, takiego jak DDP lub difosforan guanosín do podjednostki α powoduje powiązanie trzech podjednostek, tworząc kompleks znany jako Gαβγ lub G-Gdp, który jest powiązany do membrany.
Jeżeli cząsteczka PKB jest następnie wymieniana przez cząsteczkę GTP, podjednostka α przyłączona do GTP oddziela się z podjednostek β i γ, tworząc oddzielny kompleks znany jako Gα-GTP, który jest w stanie zmienić aktywność jej enzymów lub przewoźnika Diana białka.
Aktywność hydrolityczna tej podjednostki pozwala zakończyć aktywację, wymieniając GTP na nowy PKB, przechodząc do nieaktywnej konformacji.
W przypadku braku wzbudzonych receptorów związanych z procesem wymiany PKB PKB, jest bardzo powolne, co oznacza, że heterotrymiczne białka GD wymieniają PKB przez GTP na fizjologicznie ważną prędkością, gdy są połączone z wzbudzonymi receptorami.
Bibliografia
- Gilman, g. (1987). Białka G: transdury sygnałów generowanych odbiornik. Coroczne recenzje w biochemii, 56, 615-649.
- Milligan, g., I kostenis i. (2006). Heterotrimic G-białka: krótka historia. British Journal of Pharmacology, 147, 546-555.
- OfficeManns, s. (2003). Białka G jako transdury w sygnalizacji transbłonowej. Postęp w biofizyce i biologii molekularnej, 83, 101-130.
- Simon, m., Strathmann, m. P., I Gautam, n. (1991). Różnorodność białek G w transdukcji sygnału. Nauka, 252, 802-808.
- Syrowatkina, v., Wesoły, k. ALBO., Dey, r., & Huang, x. (2016). Regulacja, sygnalizacja i funkcje fizjologiczne białek G. Journal of Molecular Biology, 428(19), 3850-3868.
- « CROTALUS TRERIRIATUS CHARAKERICATORYKA, SIEDZINIE, REPRODUKCJA
- Charakterystyka grzmotu, siedlisko, taksonomia, nieruchomości »

