Nukleofilowy atak nukleofilowy, typy, przykłady, nukleofilność
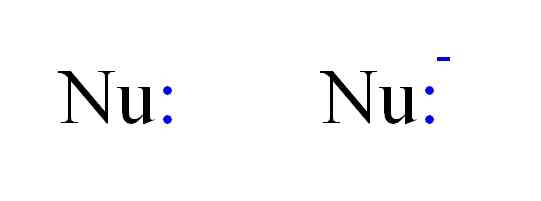
- 2060
- 637
- Herbert Wróblewski
A nukleofil Wszystko to atom, jon lub cząsteczka stara się przekazywać pary elektronów na substancje o dodatnich obciążeniach lub regionach. Słowo oznacza „miłość do jąder”. Gdy atom lub obszar molekularny jest słaby w elektronach, doświadcza siły większego przyciągania przez jądra atomowe; I dokładnie ta atrakcja przyciąga nukleofile.
Dlatego, ponieważ przyciągane są opłaty przeciwne, nukleofile muszą być gatunkami ujemnymi; lub przynajmniej posiadanie wysoce negatywnych obszarów z powodu lokalnego lub rozproszonego stężenia elektronów.
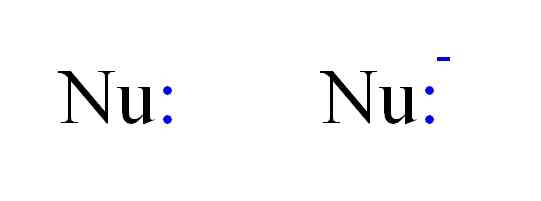 Dwa najczęstsze rodzaje nukleofilów w chemii. Źródło: Gabriel Bolívar.
Dwa najczęstsze rodzaje nukleofilów w chemii. Źródło: Gabriel Bolívar. Zatem nukleofil może być reprezentowany przez litery NU, jak na powyższym obrazku. Podwójne punkty na niebiesko odpowiadają kilku elektronom, które przekazują darowiznę na elektrofil; To jest atom lub biedna cząsteczka elektronów. Zauważ, że nukleofil może być neutralny lub anionowy, jednak oba przekazują pary elektronów.
Atak nukleofilów na elektrofile jest kamieniem węgielnym niezliczonych reakcji i mechanizmów organicznych. Przykładem nukleofilu jest anion hydroksylowy, OH-, To zachowuje się również jako baza. Jednak nukleofilowości nigdy nie należy mylić z zasadnością substancji.
[TOC]
Atak nukleofilowy
Nukleofile wyglądają. Poniższe równanie chemiczne reprezentuje atak nukleofilu:
Gnu: + R-LG → R-Nu + LG:
Nucleofil NU: przekazuje parę elektronów a r, które jest powiązane z elektroonegatywną grupą LG. W ten sposób link R-LG jest zepsuty, LG Emigra:, i powstaje nowy link R-Nu. To jest podstawa wielu reakcji organicznych.
W następnym rozdziale widać, że nukleofil może być nawet pierścieniem aromatycznym, którego gęstość elektroniczna jest rozproszona w jego środku. Podobnie nukleofil może stać się wiązaniem sigma, co oznacza, że elektrony tego samego emigrują lub wskakują do pobliskich jąder.
Może ci podać: chromian potasowy (K2CRO4)Rodzaje nukleofilów
Istnieje kilka rodzajów nukleofilów, ale ogromny duży.
Gatunki z wolnymi parami elektronów
Mówiąc o gatunkach z wolnymi parami elektronów, odnosimy się do anionów lub cząsteczek z atomami elektroungatywnymi, takimi jak tlen, azot i siarka. W części przykłady widać wiele nukleofilów tego typu, oprócz anionu OH- już wspomniane.
Podwójne linki
Nukleofil może mieć podwójne wiązania, które są odpowiedzialne za atak nukleofilowy. Muszą to jednak być podwójne wiązania o znacznej gęstości elektronicznej, więc żadna cząsteczka, która je posiada, nie będzie uważana za silny nukleofile; Oznacza to, że nie będzie miał wysokiej nukleofilności.
Na przykład rozważ pierścień benzenowy w następującej reakcji alkilowania (reakcja Friedel-Crafts):
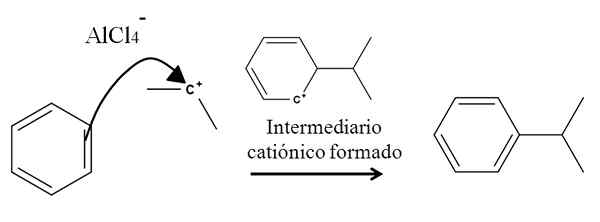 Benzen Alkilation w aromatycznym podstawieniu elektrofilowym. Źródło: Gabriel Bolívar.
Benzen Alkilation w aromatycznym podstawieniu elektrofilowym. Źródło: Gabriel Bolívar. Obecność mieszanki ALCL3-(Ch3)2CHCL pochodzi z karbokacji izopropylowej. Jego dodatnie obciążenie i niestabilność silnie przyciągają elektronę jednego z podwójnych wiązań benzenu, które atakują karbokacja, reprezentowana przez strzałkę.
W trakcie tego procesu powstaje krótka kationowa i aromatyczna intermiara, która ostatecznie przekształca się w odpowiedni produkt.
Podobnie jak w przypadku benzenu, inne substancje z podwójnymi wiązaniami mogą działać jako nukleofile, pod warunkiem, że warunki reakcji są najbardziej odpowiednie. Podobnie, muszą znajdować się atomy znajdujące się w pobliżu podwójnego wiązania, które przekazują gęstość elektroniczną, tak że „ładowały” elektrony.
Linki sigmas
Wiązania sigma jako takie nie są nukleofilami; Ale może się zachowywać jako taka po rozpoczęciu reakcji i zaczyna się mechanizm. Rozważ następujący przykład:
Może ci służyć: sole lindingowe: co to są, nomenklatura, właściwości, przykłady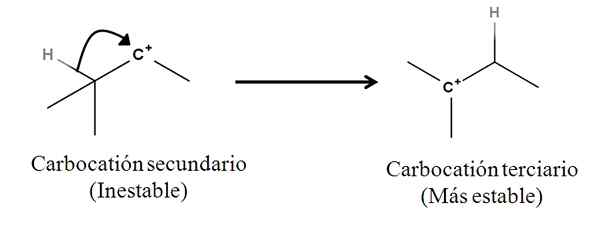 Konwersja karbokacji wtórnej do trzeciorzędowej przez migrację z anionu wodornego. Źródło: Gabriel Bolívar.
Konwersja karbokacji wtórnej do trzeciorzędowej przez migrację z anionu wodornego. Źródło: Gabriel Bolívar. Wiązanie Sigma C-H sąsiadujące z karbokacją porusza się w jego kierunku, zachowując się jak nukleofil (patrz ruch zakrzywionej strzałki). W tym sensie wynikiem jest to, że anion H porusza się- do sąsiedniego węgla, ale tak szybko, że wiązanie sigma i jego para elektronów jako czynnik nukleofilowy tego mechanizmu.
Przykłady nukleofilu
W tej sekcji wspomniano o kilku przykładach pierwszego rodzaju nukleofilów, które są bardzo obfite i ważne w chemii organicznej i nieorganicznej.
Halogenomory
Halogenuros (f-, Cl-, Br- i ja-) Są nukleofilami. Muszę przekazać jedną z czterech par elektronów walencyjnych. W zależności od prędkości, z jaką jeden z tych halogenomów atakuje elektrezę, będzie miał większą lub mniejszą nukleofilność.
Ogólnie rzecz biorąc- Jest lepszy nukleofil niż F- i inne halogenury, ponieważ łatwiej jest utworzyć kowalencyjny ogniwo, ponieważ jest on bardziej polaryzowalny; To znaczy bardziej nieporęczne i z mniejszą wytrwałością, aby zrezygnować z pary elektronów.
Elektronowiowe cząsteczki atomu
 Cząsteczki wody
Cząsteczki wody Woda, hah, jest nukleofilem, ponieważ atom tlenu ma wysoką gęstość ujemną i wolne pary elektronów w celu przekazania i tworzenia kowalencyjnego wiązania. Również alkohole, ROH, są nukleofilami, z tych samych powodów, co woda.
Małe cząsteczki azotu, takie jak amoniak, NH3, To również są nukleofilami. Wynika to z faktu, że azot może przekazać samotną parę elektronów. Podobnie, aminy, RNH2, Są również nukleofilami.
A oprócz małych cząsteczek z tlenem lub azotem siarki liczą się również jako nukleofile. Tak jest w przypadku siarkowodoru, h2S i tusza, rsh.
Siarka jest lepsza nukleofil niż. Do tego faktu należy również dodać, że jego atom jest bardziej obszerny, czyli bardziej polaryzowalny, a zatem jest w stanie tworzyć kowalencyjne wiązania z mniejszym trudnością.
Może ci służyć: Metoda MOHR: Podstawy, reakcje, procedura, zastosowaniaAniony
Natlenione, azot, siarcze aniony, a ogólnie kilka z nich to silne nukleofilki. Dzieje się tak, ponieważ mają teraz obciążenie ujemne, które dodatkowo nasila obecność pary elektronów, które przekazują darowizny.
Rozważmy na przykład następujące aniony umieszczone w malejącym rzędu nukleofilowości:
: Ch3- >: NH2- >: Och- >: F-
Carboanion Ch3- Jest to najsilniejszy nukleofil, ponieważ atom węgla nie stabilizuje obciążenia ujemnego, którego elektrony są „zdesperowane” przez pobliskie jądra. Nie dzieje się tak z Amiduro, NH2-, którego atom azotu lepiej stabilizuje obciążenie ujemne i daje parę elektronów łatwiej niż OH- lub f-.
Nukleofilność
Nukleofilność określa, jak silny jest charakter nukleoficzny gatunku. Zależy to od wielu czynników, ale najważniejsze są przeszkody steryczne podczas ataku nukleofilowego i działania rozpuszczalnika.
Im mniejszy nukleofil, tym szybszy i skuteczny będzie twój atak elektrofilu. Ponadto, o ile niższe interakcje między rozpuszczalnikiem a nukleofilem. Dlatego, zgodnie z tym, i- ma większą nukleofilność niż F-.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- James Ashenhurst. (2020). Trzy klasy nukleofilów. Odzyskane z: MastorganicChemistry.com
- Profesor Patricia Shaley. (2012). Nukleofile i elektrofile. University of Illinois. Wyzdrowiał z: butanu.Chem.UIUC.Edu
- Wikipedia. (2020). Nukleofil. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (11 lutego 2020). Definicja nukleofilów w chemii. Odzyskane z: Thoughtco.com
- Rachael Curtis. (5 czerwca 2019). Nukleofil. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- « Właściwości systemu termodynamicznego, typy, przykłady
- Koncepcja, cechy i przykłady narratora równoznacznego »

