Prawo o wielu proporcjach
- 2502
- 274
- Herbert Wróblewski
Jakie jest prawo wielu proporcji?
Prawo o wielu proporcjach Stwierdza, że jeśli dwa elementy utworzą więcej niż jeden związek, gdy reagują na siebie, wówczas odsetek mas, z którymi jedno z nich jest łączone ze stałą masą drugiej, jest to równe zależności małej liczby.
Oświadczenie prawa może wydawać się złożone, jeśli nie masz pod ręką. Rozważ zatem niektóre ciasteczka Oreos, złożone z dwóch czekoladowych pokryw i paska słodkiego kremu: T2C (t = pokrywka i c = krem). Gdybyśmy chcieli wymyślić bardziej solidne ciastko oreo, dodalibyśmy kolejny pasek kremu, aby mieć podwójny krem (t2C2 lub TC).
 W deserach, takich jak pliki cookie oreos, mamy proporcje, które można zróżnicować, aby przygotować inne ich wersje. Źródło: Brokensphere, CC BY-SA 3.0 https: // creativeCommons.Org/licencje/by-sa/3.0 Via Wikimedia Commons
W deserach, takich jak pliki cookie oreos, mamy proporcje, które można zróżnicować, aby przygotować inne ich wersje. Źródło: Brokensphere, CC BY-SA 3.0 https: // creativeCommons.Org/licencje/by-sa/3.0 Via Wikimedia Commons Moglibyśmy również dodać kolejny, aby ciastko miał trzy razy więcej śmietany niż konwencjonalne ciastko (t2C3). Co jeśli umieścimy kolejną czekoladową pokrywę na środku białych pasków (t3C2)? Opcje są nieograniczone; Ale zawsze dodajemy pokrywkę lub krem. Nie myślimy o połowie pokrywki (1/2 t) lub piątej kremu (1/5 c), ponieważ byłoby to niewłaściwe.
W ten sam sposób, w jaki zdarza się to z pierwiastkami chemicznymi: ich atomy nie dzielą się, tworząc związki. Dlatego masy T lub C wśród ich związków „zawsze” prosty związek.
Wyjaśnienie
Proporcje
Prawo wielu proporcji, wraz z prawem zdefiniowanych proporcji, poprzedziło stechiometrię i pierwsze wzory chemiczne. Zapomnijmy o ciasteczkach, ale zachowajmy ich symbole: T i C. Poprzez eksperymenty odkryto, że pierwiastki t i c tworzą kilka związków: t2C, TC i T2C3.
Przed formułami chemicznymi nie można było natychmiast wiedzieć, które były proporcjami mas T i C w takich związkach. Musiałem je najpierw ustalić. W związku odkryto, że masa T podwoiła się do masy C; Mówiąc, 2 gramy t łączą się z 1 gramem C.
Może ci służyć: pojemność: jednostki, wzory, obliczenia, przykładyNastępnie, w drugim związku, masy T i C musiały być dopasowane: 2 gramów t są teraz łączone z 2 gramami C. Tutaj pojawia się pytanie: co, jeśli T i C nadal mogą utworzyć inny związek? Jeśli tak, z pewnością powstałoby to z 2 gramami t, ale tym razem byłyby one połączone z 3 gramami C (1 gram + 1 gram + 1 gram).
Proste relacje masowe
Proporcje mas, z którymi reaguj T i C, pozwalają na ustanowienie ich wzorów chemicznych: T2C (2 grams t: 1 gram c), tc (2 gramów t: 2 gramów c) i t2C3 (2 gramy t: 3 gramów c). Jeśli chcemy porównać relacje mas T lub C w tych związkach, konieczne jest, aby jedna z jego mas pozostała stała; W takim przypadku T: 2 gramów.
Dlatego określamy proporcje masy C w tych trzech związkach:
- T2C: 1 gram c/2 gramów t
- TC: 2 gramy c/2 gramów t
- T2C3: 3 gramów c/2 gramów t
Będziemy mieli związek dla masy C równej 1: 2: 3. Oznacza to, że w TC jest 2 razy więcej c niż w t2C i 3 razy więcej c w t2C3 niż w t2C. Jak widać, 1: 2: 3 to małe liczby całościowe (nawet nie przekraczają tuzina).
Przykłady prawa wielu proporcji
W następujących przykładach zastosowano te same poprzednie kroki, ale weźmiemy pod uwagę masy molowe odpowiednich elementów, zakładając jeden kret związku.
ORZECH KOKOSOWY2

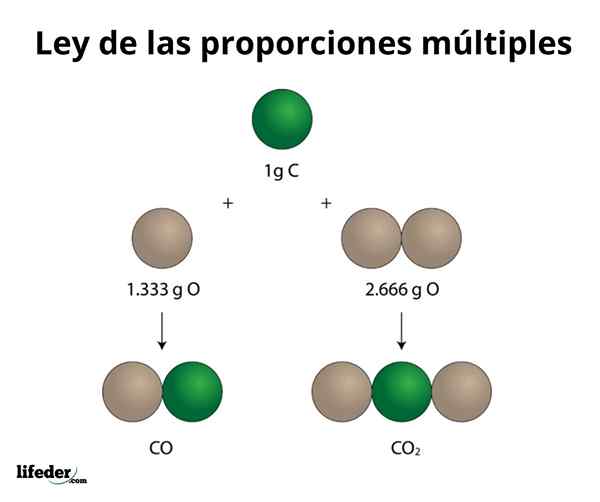
Ten przykład wyjaśnia w prosty sposób, jak działa prawo wielu proporcji; W CO (tlenek węgla) jest 1.333 gramów tlenu dla każdego grama węgla. W dwutlenku węgla (CO₂) jest 2.666 gramów tlenu dla każdego grama węgla. Dlatego odsetek tlenu w obu związkach wynosi 1: 2, mała liczba całkowita.
H2OH2ALBO2
Prawo o wielu proporcjach dotyczy pary H2OH2ALBO2.
Może ci służyć: 30 przykładów zawiesin chemicznychW mol H2Lub 2 gramy wodoru są łączone z 16 gramami tlenu. Tymczasem w mol H2ALBO2, 2 gramy wodoru łączy się z 32 gramami tlenu. Aby sprawdzić, czy prawo to zostało spełnione, musimy ustawić tę samą masę dla jednego z pierwiastków w obu związkach. Tym razem jest wodór: 2 gramy.
Masowe proporcje dla H2Lub h2ALBO2 Czy:
- H2O: 16 gramów lub/2 gramów h
- H2ALBO2: 32 gramów lub/2 gramów h
Stosunek masy O wynosi 16:32. Możemy jednak to uprościć, dzieląc się przez 16, pozostając 1: 2. Ponownie, ostateczny związek składa się z małych liczb całkowitych.
południowy zachód2-południowy zachód3
W molu2, 32 gramy siarki łączy się z 32 gramami tlenu. Tymczasem w molu3, 32 gramów siarki łączy się z 48 gramami tlenu. Masa siarki jest taka sama dla obu związków, więc możemy bezpośrednio porównać proporcje tlenu:
- południowy zachód2: 32 gramów lub
- południowy zachód3: 48 gramów lub
Jest stosunkiem masy tlenu między obiema związkami równą 32:48 lub 1: 1.5. Ale nie było tam, że powinny być liczby całkowitego? Związek 1: 1.5 (1/1.5) Można go również zapisać jako 2: 3 (0.6) i znowu będziemy mieli małe liczby: 2 i 3.
Zauważ, że moglibyśmy również napisać związek jako 48:32 lub 1.5: 1, będąc wynikiem 3: 2. Prawo się nie zmienia, tylko interpretacja związku: jest 1.5 lub 3/2 razy więcej tlenu w SO3 że w SO2; to samo stwierdzenie, że są 2/3 lub 0.6 razy mniej tlenu w SO2 że w SO3.
NIE? NIE2-N2NA2ALBO3-N2ALBO5
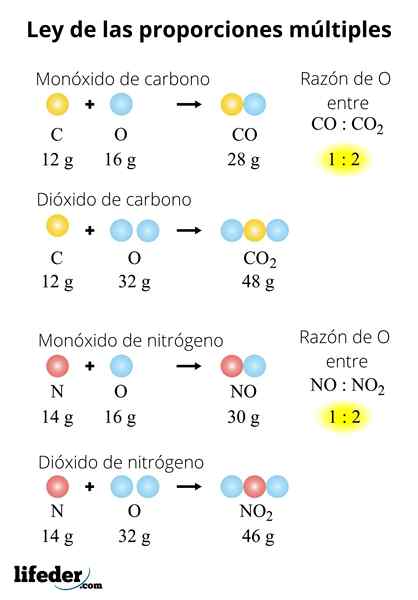
Prawo można również zastosować do serii związków. Rozważ tlenki azotu: nie jest to nie2-N2NA2ALBO3-N2ALBO5. Aby ocenić to prawo w nich, musimy ustawić masę azotu: 28 gramów. Ponieważ? Ponieważ nie i nie2 Mają atom azotowy mniej niż inne tlenki:
- 2 (nr): 28 gramów N/32 gramów lub
- 2 (nie2): 28 gramów N/64 gramów lub
- N2O: 28 gramów N/ 16 gramów lub
- N2ALBO3: 28 gramów N/ 48 gramów lub
- N2ALBO5: 28 gramów N/ 80 gramów lub
Zapomnijmy o azotu i skupmy się na gramach tlenu:
- 2 (nie): 32 gramów lub
- 2 (nie2): 64 gramów lub
- N2O: 16 gramów lub
- N2ALBO3: 48 gramów lub
- N2ALBO5: 80 gramów lub
Jest stosunkiem mas lub równych 32: 64: 16: 48: 80. Aby to uprościć, dzielimy wszystkie jego liczby między najmniejszą, 16, jako 2: 4: 1: 3: 5.
To znaczy: 2 razy więcej tlenu w NO niż w n2Lub 4 razy więcej tlenu w NO2 że w n2Lub 3 razy więcej tlenu w n2ALBO3 że w n2Lub i 5 razy więcej tlenu w n2ALBO5 że w n2ALBO. Znowu mamy małe liczby całkowite, od 1 do 5.
Ograniczenia
Prawo wielu proporcji nie zawsze jest spełnione. Na przykład masy molowe lub ciężary atomowe pierwiastków nie są całymi postaciami, ale ma wiele dziesiętnych dziesiętnych. To całkowicie modyfikuje obliczone relacje, które przestają być proste.
Podobnie prawo nie jest spełnione w przypadku ciężkich związków, takich jak niektóre węglowodory. Na przykład Undecano, CjedenaścieH24, ma 1.0083 lub 121/120 razy więcej wodoru niż Dean, C10H22, którego związek składa się z 121 i 120, które przekraczają tuzin; Nie są małymi liczbami całkowitymi.
I wreszcie, prawo zawodzi w przypadku związków niestoichiometrycznych, jak w przypadku wielu tlenków i siarków.
Wniosek
Prawo wielokrotnego proporcji stwierdza, że gdy dwa elementy tworzą więcej niż jeden związek, różne masy elementu, które łączą się z tą samą masą drugiego elementu, mają proporcję małej liczby.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2020). Prawo o wielu proporcjach. Źródło: w:.Wikipedia.org
- Redaktorzy Enyclopaedia Britannica. (2020). Prawo o wielu proporcjach. Odzyskane z: Britannica.com
- ChemistryGod. (4 czerwca 2019). Prawo wielu proporcji przez Dalton. Odzyskane z: ChemistryGod.com
- Garcia Nissa. (2020). Prawo wielu proporcji: definicja i przykład. Badanie. Odzyskane z: Study.com

