Alifatyczne właściwości węglowodorów, nomenklatura, reakcje, typy

- 1479
- 68
- Matylda Duda
Węglowodory alifatyczne Są to wszyscy, którzy nie mają aromatyczności, nie w sensie węchowym, ale w odniesieniu do stabilności chemicznej. Klasyfikacja węglowodorów w ten sposób jest dziś zbyt niejednoznaczna i nieprecyzyjna, ponieważ nie rozróżnia różnych rodzajów węglowodorów, które nie są aromatyczne.
Zatem mamy alifatyczne węglowodory i węglowodory aromatyczne. Te ostatnie są rozpoznawane przez ich podstawową jednostkę: pierścień Benncénico. Inne, z drugiej strony, mogą przyjąć dowolną strukturę molekularną: liniowy, rozgałęziony, cykliczny, nienasycony, wielopierścieniowy; tak długo, jak nie mają sprzężonych systemów, takich jak benzen.
 Paliwo płynne zapalniczek składa się z mieszanki węglowodorów alifatycznych. Źródło: Pixnio.
Paliwo płynne zapalniczek składa się z mieszanki węglowodorów alifatycznych. Źródło: Pixnio. Termin „alifatyczny” narodził się od greckiego słowa „Aleiphar”, co oznacza tłuszcz, również używany w odniesieniu do olejków. Dlatego w XIX wieku klasyfikacja ta została przypisana do węglowodorów uzyskanych z tłustych ekstraktów; Podczas gdy węglowodory aromatyczne były ekstrahowane z drzewa i pachnących żywic.
Jednak, ponieważ podstawa chemii organicznej, odkryto, odkryto, że istnieje właściwość chemiczna, która różnicowała węglowodory, nawet ważniejsze niż ich naturalne źródła: aromatyczność (a nie zapach).
W ten sposób węglowodory alifatyczne przestały być tylko tymi uzyskanymi z tłuszcz. W tej rodzinie mamy alkeny i alkiny, niezależnie od tego, czy są one liniowe czy cykliczne. Dlatego „alifatyczny” jest uważany za niedokładny; Chociaż jest to przydatne do rozwiązania niektórych ogólnych aspektów.
Na przykład, gdy powiedziano „ekstremalne” lub „łańcuchy” alifatyczne, regiony molekularne wspominają tam, gdzie nieobecne są pierścienie aromatyczne. Ze wszystkich węglowodorów alifatycznych najprostszym z definicji jest metan, cho4; Podczas gdy benzen jest najprostszym z aromatycznych węglowodorów.
[TOC]
Właściwości węglowodorów alifatycznych
Właściwości węglowodorów alifatycznych oscylują w różnych stopniach w zależności. Istnieją niskie i wysokie masy cząsteczkowe, a także liniowe, rozgałęzione, cykliczne lub wielopierścieniowe, nawet te o niesamowitych trzech wymiarowych strukturach; jak w przypadku Kubańczyka, w postaci kostki.
Istnieją jednak pewne ogólności, które można wspomnieć. Większość alifatycznych węglowodorów to gazy lub ciecze hydrofobowe i apolowe, mające trochę bardziej apolarne niż inne, ponieważ nawet te, w których łańcuchy węgla mają halogen, tlen, azot lub atomy siarki są zawarte na liście.
Może ci służyć: bor: historia, właściwości, struktura, użyciaSą to również łatwopalne związki, ponieważ są podatne na utlenianie w powietrzu przed minimalnym źródłem ciepła. Ta funkcja staje się bardziej niebezpieczna, jeśli dodamy jego wysoką zmienność, ze względu na słabe interakcje dyspersyjne, które utrzymują spójne cząsteczki alifatyczne.
Na przykład widzimy to w butanie, gazie, który można skropić ze względną łatwością, a także propanem. Oba są bardzo niestabilne i łatwopalne, więc są aktywnymi elementami gazu kuchennego lub zapalniczek kieszonkowych.
Oczywiście taka zmienność ma tendencję do zmniejszania się, ponieważ masa cząsteczkowa i węglowodór powodują coraz więcej lepkich cieczy.
Nomenklatura
Nomenklatura węglowodorów różni się nawet bardziej niż jego właściwości. Jeśli są alko lub alkiny, następują te same standardy określone przez IUPAC: Wybierz najdłuższy łańcuch, przypisując najniższe wskaźniki do najbardziej wymienionego końca lub do heteroatomów lub bardziej grup reaktywnych.
W ten sposób wiesz, w którym węgiel znajduje się każdy podstawnik, a nawet nienasycenie (podwójne lub potrójne linki). W przypadku cyklicznych węglowodorów nazwa jest poprzedzona podstawnikami wymienionymi w kolejności alfabetycznej, a następnie słowem „cykl”, zliczając liczby węgla, które go integrują.
Rozważmy na przykład dwa następujące cykloheksany:
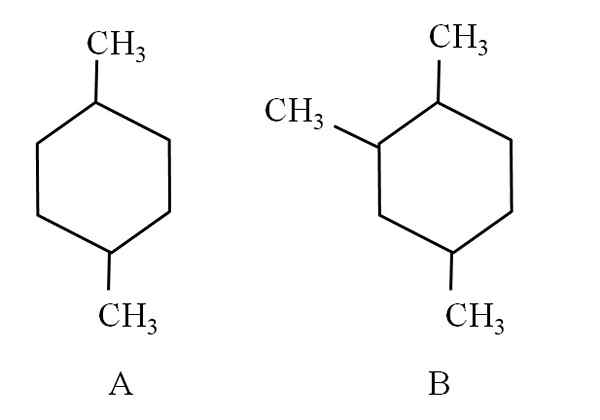 Dwa cykloheksany, które są klasyfikowane jako węglowodory alifatyczne. Źródło: Gabriel Bolívar.
Dwa cykloheksany, które są klasyfikowane jako węglowodory alifatyczne. Źródło: Gabriel Bolívar. Cykloheksan A, nazywa się 1,4-dimetylocykloheksan. Gdyby pierścień miał pięć węgli, byłoby to 1,4-dimetylcyklopentano. Tymczasem cykloheksan B nazywa się 1,2,4-trimetylocykloheksan, a nie 1,4,6-cykloheksan, ponieważ ma na celu stosowanie najniższych wskaźników.
Teraz nomenklatura może stać się bardzo skomplikowana dla struktur operacyjnych węglowodorów. Dla nich istnieją bardziej szczegółowe zasady, które należy wyjaśnić osobno i ostrożnie; Podobnie jak w przypadku celów, terpenes, polityk i związków wielopierpliwych.
Reakcje
Spalanie
Na szczęście reakcje są mniej zróżnicowane dla tych węglowodorów. Jeden z nich został już wspomniany: łatwo spalanie, wytwarzając dwutlenek węgla i wodę, oprócz innych tlenków lub gazów w zależności od obecności heteroatomów (Cl, N, P, O itp.). Jednak CO2 i H2Lub są głównymi produktami spalania.
Dodatek
Jeśli mają nienasycenie, mogą ponieść reakcje dodawania; Oznacza to, że włączają małe cząsteczki do swojego szkieletu jako podstawników zgodnie z określonym mechanizmem. Wśród tych cząsteczek mamy cząsteczkę wody, wodoru i halogenów (f (F2, Cl2, Br2 i ja2).
Fluogenizacja
Z drugiej strony węglowodory alifatyczne podczas występowania promieniowania ultrafioletowego (Hv), a ciepło może przełamać łącza C-H, aby je zmienić za pomocą linków C-X (C-F, C-Cl itp.). Jest to reakcja halogenna, która obserwuje się w bardzo krótkim łańcuchu, takim jak metan lub pentan.
Może ci służyć: azotyny: właściwości, struktura, nomenklatura, formacjaCRAQUEO
Kolejną reakcją, którą mogą cierpieć węglowodory alifatyczne, zwłaszcza alkanów długiego łańcucha, jest pękanie termiczne. Składa się z podaży intensywnego ciepła, tak że energia cieplna rozbiła wiązania C-C, a zatem powstają małe cząsteczki, bardziej cytowane na rynku paliwowym, z dużych cząsteczek.
Cztery powyższe reakcje są głównymi, które mogą cierpieć z węglowodorem alifatycznym, przy czym spalanie jest najważniejsze ze wszystkich, ponieważ nie dyskryminuje żadnego związku; Wszyscy spali się w obecności tlenu, ale nie wszyscy dodają cząsteczki lub włamają się do małych cząsteczek.
Chłopaki
Alifatyczne węglowodory grupują niekończące się związki, które z kolei są klasyfikowane bardziej specyficzne, wskazując na stopień ich nienasycenia, a także rodzaj, jaką mają strukturę.
Zgodnie z tym, jak są nienasycone, mamy alkany (nasycone), alkeny i alkyny (nienasycone).
Alkany charakteryzują się posiadaniem prostych łączy C-C, podczas gdy w alkenach i alkinach obserwujemy odpowiednio łącza C = C i C≡C. Bardzo ogólnym sposobem ich wizualizacji jest zastanowienie się nad szkieletami węglowymi alkanów jako zygzakowatymi i złożonymi łańcuchami, będąc „kwadratowymi” dla alkenów i „prostych linii” dla alkin.
Wynika to z faktu, że wiązania podwójne i potrójne mają ograniczenie energii i zachowania w swoich obrotach, „stwardnianie” ich struktur.
Alkitos i alkiny mogą być rozgałęzione, cykliczne lub wielopiękowe. Właśnie dlatego Cycloalcanos, Cycloalquenos, Cycloalquinos i związki takie jak decalin (struktura rowerowa), Adamantano (podobne do czapki baseballowej), heptalen, gonano, są również rozważane hydrocharbony alifatyczne alifatyczne.
Z alkenów powstają inne rodzaje węglowodorów, takie jak cele (z dwoma podwójnymi wiązaniami), poliew (z wieloma podwójnymi alternatywnymi wiązaniami) i terpeny (związki pochodzące z izoprenu, diene).
Aplikacje
Ponownie zastosowania tych węglowodorów mogą się różnić w zależności od tego, który z nich jest rozważany. Jednak w sekcjach właściwości i reakcji wyjaśniono, że całe spalanie, nie tylko uwolnienie cząsteczek gazowych, ale także światło i ciepło. Zatem są to zbiorniki energetyczne, przydatne do służby jako paliwa lub źródła ciepła.
Dlatego są one używane jako część składu benzyny, dla gazu ziemnego, w bunsenach i ogólnie rzecz biorąc, aby móc powstrzymać ogień.
Może ci służyć: reguła oktetuJednym z najbardziej niezwykłych przykładów jest acetylen, HC≡CH, którego spalanie pozwala na wzbudzenie jonów metali próbki w atomowej spektrometrii absorpcji wykonywanej w testach analitycznych. Podobnie, wynikowy pożar może być używany do spoin.
Ciekłe węglowodory alifatyczne, takie jak parafinki, są często stosowane jako rozpuszczalniki ekstrakcji tłuszczu. Ponadto jego działanie rozpuszczalnika można użyć do usuwania plam, emaliów, obrazów lub po prostu przygotowania roztworów określonego związku organicznego.
Największa masa cząsteczkowa, już lepka lub stała, jest przeznaczona do opracowania żywic, polimerów lub leków.
W odniesieniu do terminu „alifatyczny” jest zwykle używany w odniesieniu do tych regionów, w makromolekule, które nie mają aromatyczności. Na przykład asfalty są opisywane powierzchownie jako jądro aromatyczne z łańcuchami alifatycznymi.
Przykłady
Początkowo powiedziano, że metan jest najprostszym z węglowodorów alifatycznych. Za nimi podąża propan, cho3Ch2Ch3, Butano, rozdz3Ch2Ch2Ch3, Pentano, rozdz3Ch2Ch2Ch2Ch3, Octan, Nonano, Dean i tak dalej, mając coraz dłuższe alkan.
To samo dotyczy etylenu, Cho2= Ch2, Propeno, rozdz3CH = CH2, Buteno, rozdz3Ch2CH = CH3, I dla reszty alkin. Jeśli są dwa podwójne wiązania, są one oley, a jeśli są więcej niż dwa, Polienas. Podobnie w tym samym szkielecie mogą występować podwójne i potrójne linki, zwiększając złożoność strukturalną.
Wśród cykloalcanos możemy wspomnieć o cyklopropanie, cyklobutanie, cyklopentano, cykloheksanie, cykloheptano, cyklooktanu, a także cykloheksenach i cykloheksynie. Z wszystkich tych węglowodorów uzyskuje się rozgałęzione pochodne, co dodatkowo pomnażając dostępne przykłady (takie jak 1,4-dimetylocykloheksano).
Z najbardziej reprezentatywnych terpenów mamy limonen, mentol, pinene, witaminę A, Escualeno itp. Polietylen jest nasyconym polimerem z jednostkami -ch2-Ch2-, Jest to również przykład tych węglowodorów. Inne przykłady zostały już cytowane w poprzednich sekcjach.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Helmestine, Anne Marie, pH.D. (22 sierpnia 2019). Alifatyczna definicja węglowodorów. Odzyskane z: Thoughtco.com
- Wikipedia. (2019). Związek alifatyczny. Źródło: w:.Wikipedia.org
- Chemia librettexts. (20 sierpnia 2019). Węglowodory alifatyczne. Odzyskane z: chem.Librettexts.org
- Elizabeth Wyman. (2019). Węglowodory alifatyczne: definicja i właściwości. Badanie. Odzyskane z: Study.com
- « Wymiar społeczny będący człowiekiem, edukacją, wiedzą, prawem, zdrowiem
- 100 ciekawych danych zwierząt »

